题目内容
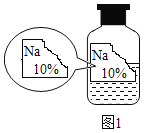
【题目】实验室有一瓶标签残缺并且瓶盖没有完全密封的无色溶液(如图),是NaCl、NaOH、Na2CO3、NaHCO3中的一种溶液,为确认原瓶中是何种溶质并判断其是否变质,进行了如下的究活动:
(查阅资料)
Ⅰ.BaCl2溶液呈中性;
Ⅱ.常温下,有关物质的相关信息如表:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
常温下的溶解度(g/100g水) | 36 | 109 | 21.5 | 9.6 |
常温下稀溶液的pH | 7 | 13 | 11 | 9 |
从物质的相关信息可知,原溶液的溶质一定不是 NaHCO3因为_____。
(进行实验)
①取少量样品,测得溶液的pH大于7,则原溶液的溶质肯定不是_____。
②另取样品又进行了如下实验,实验过程如图:
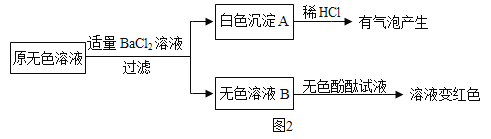
生成白色沉淀A的化学方程式_____。通过实验可以判断样品原无色溶液中含有的溶质有_____。
下列试剂能替代上述实验中无色酚酞试液检验的是_____。(填序号)
Ⅰ.FeCl3 Ⅱ.HNO3 Ⅲ.CO2 Ⅳ.CuO
(获得结论)实验完成后,最终得到的结论:原瓶中的溶质是_____,且已变质;变质的原因是(用化学方程式表示)_____。
【答案】碳酸氢钠的饱和溶液溶质质量分数在该温度下不能达到 10% NaCl BaCl2+Na2CO3=BaCO3↓+2NaCl; NaOH、Na2CO3; I NaOH; 2NaOH+CO2=Na2CO3+H2O
【解析】
氢氧化钠溶液和碳酸钠溶液都是显碱性溶液,都能使酚酞试液变红色,使石蕊试液变蓝色;氢氧化钠和二氧化碳反应生成碳酸钠和水,和氯化铁反应生成氢氧化铁沉淀和硫酸钠,碳酸钠和氯化钡反应生成白色沉淀碳酸钡和氯化钠。
[查阅资料]通常情况下,饱和碳酸氢钠溶液溶质质量分数=![]() ×100%=8.8%,因此猜想Ⅳ一定错误;
×100%=8.8%,因此猜想Ⅳ一定错误;
[进行实验]①这是因为氯化钠溶液显中性,pH=7;
②生成白色沉淀A是碳酸钙,碳酸钡和氯化钙反应生成碳酸钡沉淀和氯化钠,反应的化学方程式:Na2CO3+BaCl2═BaCO3↓+2NaCll,通过实验可以判断,产生白色沉淀,说明溶液中含有碳酸钠,B溶液中加入酚酞试液变红色,说明溶液中含有氢氧化钠,因此原无色溶液中含有的溶质有碳酸钠、氢氧化钠;
实验②中检验无色溶液B时,可以代替酚酞溶液的试剂(或试纸)是FeCl3溶液,这是因为氢氧化钠和其反应生成红褐色沉淀氢氧化铁;
[获得结论]实验完成后,最终得到的结论:原瓶中的溶质是NaOH,且已变质;变质的原因用化学方程式表示为2NaOH+CO=NaCO+HO。

 阅读快车系列答案
阅读快车系列答案【题目】实验室有一瓶标签残缺并且瓶盖没有完全密封的无色溶液(如图),是NaCl、NaOH、Na2CO3、NaHCO3中的一种溶液,为确认原瓶中是何种溶质并判断其是否变质,进行了如下的究活动:
(查阅资料)
Ⅰ.BaCl2溶液呈中性;
Ⅱ.常温下,有关物质的相关信息如表:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
常温下的溶解度(g/100g水) | 36 | 109 | 21.5 | 9.6 |
常温下稀溶液的pH | 7 | 13 | 11 | 9 |
从物质的相关信息可知,原溶液的溶质一定不是 NaHCO3因为_____。
(进行实验)
①取少量样品,测得溶液的pH大于7,则原溶液的溶质肯定不是_____。
②另取样品又进行了如下实验,实验过程如图:
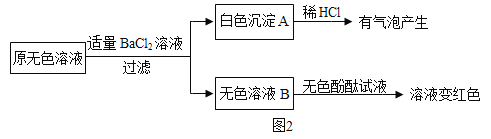
生成白色沉淀A的化学方程式_____。通过实验可以判断样品原无色溶液中含有的溶质有_____。
下列试剂能替代上述实验中无色酚酞试液检验的是_____。(填序号)
Ⅰ.FeCl3 Ⅱ.HNO3 Ⅲ.CO2 Ⅳ.CuO
(获得结论)实验完成后,最终得到的结论:原瓶中的溶质是_____,且已变质;变质的原因是(用化学方程式表示)_____。