题目内容
【题目】现将30.0g铜锌合金放在烧杯中,然后向烧杯中不断加入稀盐酸。当加入148.4g稀硫酸时,不再有气体生成,此时测得烧杯中混合物的质量为178.2g。
(1)反应中生成气体的质量是_____g。
(2)求反应后烧杯中溶液的溶质质量分数(写出计算过程)。
【答案】(1)0.2;(2)10.4%(详见解析)
【解析】
(1)根据质量守恒定律,参加反应的反应物的总质量等于生成的生成物的总质量,减少为生成的气体的质量,故反应中生成气体的质量是30g+148.4g-178.2g=0.2g;
(2)设生成的硫酸锌的质量为x,参加反应的锌的质量为y。
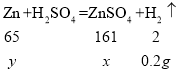
![]() y=6.5g;
y=6.5g;
![]() x=16.1g;
x=16.1g;
反应后烧杯中溶液的溶质质量分数为![]()
答:反应后烧杯中溶液的溶质质量分数为10. 4%。

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
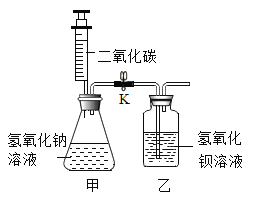
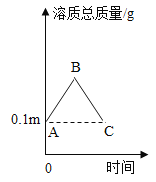
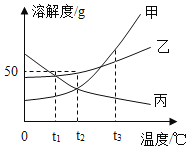
【题目】图中连线两端的物质在通常情况下可以相互反应。下列四组选项中,符合该图要求的是( )
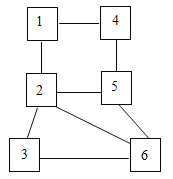
① | ② | ③ | ④ | ⑤ | ⑥ | |
A | CO2 | NaOH溶液 | 稀HCl溶液 | Ca(OH)2溶液 | CuCl2溶液 | Fe |
B | CaO | 稀HCl溶液 | Fe | 稀H2SO4溶液 | Na2CO3溶液 | Ca(OH)2溶液 |
C | Fe | 稀H2SO4溶液 | BaCl2溶液 | Cu(NO3)2溶液 | Ca(OH)2溶液 | Na2CO3溶液 |
D | Zn | 稀HCl溶液 | CaCO3 | CuSO4溶液 | NaOH溶液 | FeCl3溶液 |
A.A