题目内容
如图是初中化学里几种常见无机物间的转化关系,其中,溶液A、B、F中都只含有一种各不相同的溶质.又知NaHCO3能与稀硝酸发生下列反应:NaHCO3+HNO3=NaNO3+H2O+CO2↑,与稀盐酸、稀硫酸也能发生类似的反应.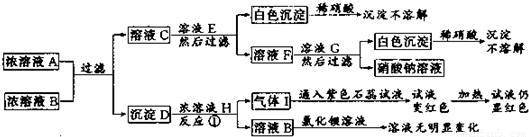
(1)写出下列字母所代表的溶液中溶质的化学式A______,B______,F______.
(2)在反应①后,为得到较纯净的该反应生成的气体,应将气体I先通过浓H2SO4、NaOH溶液、Ca(OH)2溶液、NaHCO3溶液、AgNO3溶液、无水CuSO4中的______,再通过______.
【答案】分析:气体Ⅰ通入紫色石蕊试液,试液变红,加热后试液仍显红色,说明气体中有加热不分解的物质.溶液F和溶液G反应生成不溶于稀硝酸的白色沉淀和硝酸钠,白色沉淀可能是AgCl,也可能是BaSO4,若是AgCl,则溶液F是NaCl,G是AgNO3,溶液C加入溶液E生成白色沉淀和NaCl,白色沉淀若是BaSO4,则C中含有氯化钡,溶液E 为硫酸钠,硫酸钠和氯化钡反应生成硫酸钡沉淀和氯化钠;溶液A和溶液B反应生成白色沉淀D,D能和溶液H反应产生气体,故D为碳酸盐沉淀,因此D为碳酸钡,碳酸钡和硝酸的浓溶液反应生成二氧化碳气体和硝酸钡,二氧化碳气体中混有硝酸,通到紫色石蕊试液,紫色石蕊试液变红,加热后仍然是红色;故A为碳酸钠,B为氯化钡,C为氯化钠和氯化钡的混合物,D为碳酸钡,E为硫酸钠,F为氯化钠,G为硝酸银,H为硝酸,I为二氧化碳.
解答:解:气体Ⅰ通入紫色石蕊试液,试液变红,加热后试液仍显红色,说明气体中有加热不分解的物质.溶液F和溶液G反应生成不溶于稀硝酸的白色沉淀和硝酸钠,白色沉淀可能是AgCl,也可能是BaSO4,若是AgCl,则溶液F是NaCl,G是AgNO3,溶液C加入溶液E生成白色沉淀和NaCl,白色沉淀若是BaSO4,则C中含有氯化钡,溶液E 为硫酸钠,硫酸钠和氯化钡反应生成硫酸钡沉淀和氯化钠;溶液A和溶液B反应生成白色沉淀D,D能和溶液H反应产生气体,故D为碳酸盐沉淀,因此D为碳酸钡,碳酸钡和硝酸的浓溶液反应生成二氧化碳气体和硝酸钡,二氧化碳气体中混有硝酸,通到紫色石蕊试液,紫色石蕊试液变红,加热后仍然是红色;故A为碳酸钠,B为氯化钡,C为氯化钠和氯化钡的混合物,D为碳酸钡,E为硫酸钠,F为氯化钠,G为硝酸银,H为硝酸,I为二氧化碳.
(1)由上述分析可知A为 Na2CO3,B 为 BaCl2,F 为 NaCl.
(2)在反应①后,得到的气体是二氧化碳和硝酸的混合气体,二氧化碳与碳酸氢钠不反应,硝酸与碳酸氢钠反应,因此先将混合气体通过碳酸氢钠溶液,然后通过浓硫酸进行干燥即可得到纯净的二氧化碳气体.
故答案为:(1)A Na2CO3,B BaCl2,F NaCl.
(2)NaHCO3,浓硫酸
点评:本题突破口在两种不溶于硝酸的白色沉淀,溶液A、B、F中都只含有一种各不相同的溶质,本题要考虑到反应物过量,难度较大.
解答:解:气体Ⅰ通入紫色石蕊试液,试液变红,加热后试液仍显红色,说明气体中有加热不分解的物质.溶液F和溶液G反应生成不溶于稀硝酸的白色沉淀和硝酸钠,白色沉淀可能是AgCl,也可能是BaSO4,若是AgCl,则溶液F是NaCl,G是AgNO3,溶液C加入溶液E生成白色沉淀和NaCl,白色沉淀若是BaSO4,则C中含有氯化钡,溶液E 为硫酸钠,硫酸钠和氯化钡反应生成硫酸钡沉淀和氯化钠;溶液A和溶液B反应生成白色沉淀D,D能和溶液H反应产生气体,故D为碳酸盐沉淀,因此D为碳酸钡,碳酸钡和硝酸的浓溶液反应生成二氧化碳气体和硝酸钡,二氧化碳气体中混有硝酸,通到紫色石蕊试液,紫色石蕊试液变红,加热后仍然是红色;故A为碳酸钠,B为氯化钡,C为氯化钠和氯化钡的混合物,D为碳酸钡,E为硫酸钠,F为氯化钠,G为硝酸银,H为硝酸,I为二氧化碳.
(1)由上述分析可知A为 Na2CO3,B 为 BaCl2,F 为 NaCl.
(2)在反应①后,得到的气体是二氧化碳和硝酸的混合气体,二氧化碳与碳酸氢钠不反应,硝酸与碳酸氢钠反应,因此先将混合气体通过碳酸氢钠溶液,然后通过浓硫酸进行干燥即可得到纯净的二氧化碳气体.
故答案为:(1)A Na2CO3,B BaCl2,F NaCl.
(2)NaHCO3,浓硫酸
点评:本题突破口在两种不溶于硝酸的白色沉淀,溶液A、B、F中都只含有一种各不相同的溶质,本题要考虑到反应物过量,难度较大.

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案
相关题目
A、B、C、D、E都是初中化学常见的物质,分别由H、C、O、Cl、Na、Ca等六种元素中的两种或几种组成,根据下列信息回答问题.
(1)C常温下为一种气体,且能参与植物光合作用,则C是 (写化学式).
(2)B、D和E 均是由三种元素组成的化合物,且含有一种相同的元素.通过下面对三种物质溶液的实验判断:A为 A: (写化学式),D+A反应的化学方程式为 .
(3)如图所示,每两个相邻的圆圈中的物质相互之间可以发生化学反应,若D、E含有相同的金属元素,依据各物质之间反应关系将A、B、C、D、E五种物质填到相应的圆圈里(只填写物质的编号,不能重复).
在图中所示的反应中有一个和其它的化学反应类型(基本反应类型)都不相同,写出此反应的化学方程式 .

(1)C常温下为一种气体,且能参与植物光合作用,则C是 (写化学式).
(2)B、D和E 均是由三种元素组成的化合物,且含有一种相同的元素.通过下面对三种物质溶液的实验判断:A为 A: (写化学式),D+A反应的化学方程式为 .
| B中现象 | D中现象 | E中现象 | |
| 滴加A溶液 | 无明显变化 | 有气泡出现 | 无明显变化 |
在图中所示的反应中有一个和其它的化学反应类型(基本反应类型)都不相同,写出此反应的化学方程式 .

 是,下列说法不正确的是
是,下列说法不正确的是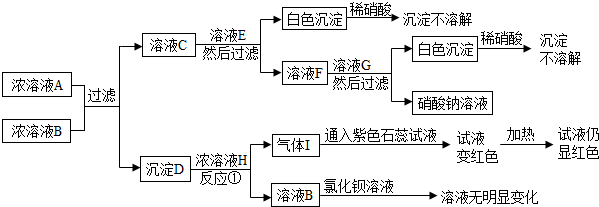
 (2013?密云县一模)A、B、C、D、E都是初中化学常见的物质,分别由H、C、O、Cl、Na、Ca等六种元素中的两种或几种组成,根据下列信息回答问题.
(2013?密云县一模)A、B、C、D、E都是初中化学常见的物质,分别由H、C、O、Cl、Na、Ca等六种元素中的两种或几种组成,根据下列信息回答问题.