题目内容
 (2013?平谷区一模)水和溶液在学习和生活中起着十分重要的作用.
(2013?平谷区一模)水和溶液在学习和生活中起着十分重要的作用.(1)自然界的水经过一系列净化处理后,成为比较清洁的自来水.自来水不是纯水,若要制取纯水,应采取的净化方法是
蒸馏
蒸馏
.碗碟上的油污用自来水很难洗净,往水中滴加少量洗涤剂后,就很容易洗净,说明洗涤剂具有乳化
乳化
功能.(2)水在实验室中有不同用途.
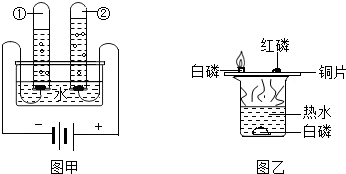
①如图甲为电解水的装置图,其反应方程式为
2H2O
2H2↑+O2↑
| ||
2H2O
2H2↑+O2↑
;
| ||
②如图乙为探究燃烧条件实验,其中热水作用
隔绝空气(氧气)、加热
隔绝空气(氧气)、加热
.(3)农业生产常用溶质的质量分数为10%~20%的NaCl溶液来选种.现将200g 25%的NaCl溶液稀释为10%的NaCl溶液,需要加水的质量为
300
300
g.(4)20℃时,NaCl溶解于水的实验数据如下表.则下列叙述正确的是
AB
AB
.| 实验序号 | 水的质量(g) | 加入NaCl质量 | 溶液的质量 |
| ① | 10 | 2 | 12 |
| ② | 10 | 3 | 13 |
| ③ | 10 | 4 | 13.6 |
| ④ | 10 | 5 | 13.6 |
B.②中所得溶液是不饱和溶液
C.20℃时NaCl的溶解度是3.6克
D.④溶液中溶质质量分数比其余溶液中溶质质量分数都大.
分析:(1)通过蒸馏能到纯水,洗涤剂具有乳化功能;
(2)①根据通电分解水的反应写出反应的方程式;
②观察装置,分析水的作用;
(3)根据在稀释溶液时溶质的质量不变计算.
(4)由表中数据可知,随着氯化钠的不断加入,溶液的质量在增加,当10g水中溶解了3.6g氯化钠后不再溶解,说明已经达到饱和状态.
(2)①根据通电分解水的反应写出反应的方程式;
②观察装置,分析水的作用;
(3)根据在稀释溶液时溶质的质量不变计算.
(4)由表中数据可知,随着氯化钠的不断加入,溶液的质量在增加,当10g水中溶解了3.6g氯化钠后不再溶解,说明已经达到饱和状态.
解答:解:(1)自来水不是纯水,通过蒸馏能得到纯水,利用洗涤剂洗掉油污是利用了洗涤剂的乳化作用;
(2)①通电分解水生成了氢气和氧气,反应的方程式是:2H2O
2H2↑+O2↑;
②由装置可知,热水作用是:隔绝空气(氧气)、加热;
(3)设需要加水的质量为x,则 200g×25%=(200g+x)×10% 解得:x=300g;
(4)A、①所得溶液的溶质质量分数为:
×100%=16.7%,故A选项正确;
B、由③中数据可知,②中所得溶液是不饱和溶液,故B选项正确;
C、由表中的数据可知,20℃时10g水最多能溶解3.6g,所以,20℃时NaCl的溶解度是36克.故C选项错误;
D、由表中数据可知,③④溶液都是饱和溶液,在相同温度下,同种物质的饱和溶液的溶质质量分数相等,故D选项错误.故答为:(1)蒸馏,乳化;(2)①2H2O
2H2↑+O2↑;②隔绝空气(氧气)、加热;(3)300;(4)A,B.
(2)①通电分解水生成了氢气和氧气,反应的方程式是:2H2O
| ||
②由装置可知,热水作用是:隔绝空气(氧气)、加热;
(3)设需要加水的质量为x,则 200g×25%=(200g+x)×10% 解得:x=300g;
(4)A、①所得溶液的溶质质量分数为:
| 2g |
| 10g+2g |
B、由③中数据可知,②中所得溶液是不饱和溶液,故B选项正确;
C、由表中的数据可知,20℃时10g水最多能溶解3.6g,所以,20℃时NaCl的溶解度是36克.故C选项错误;
D、由表中数据可知,③④溶液都是饱和溶液,在相同温度下,同种物质的饱和溶液的溶质质量分数相等,故D选项错误.故答为:(1)蒸馏,乳化;(2)①2H2O
| ||
点评:本题主要考查水的净化、应用、组成和不饱和溶液和饱和溶液方面的知识.在解答(4)时要紧紧围绕表中数据进行分析、判断,从而得出正确的结论.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (2013?平谷区一模)如图是a、b、c三种物质的溶解度曲线.把t1℃时三种物质的饱和溶液温度升高到t2℃,则三种溶液的溶质质量分数大小关系是( )
(2013?平谷区一模)如图是a、b、c三种物质的溶解度曲线.把t1℃时三种物质的饱和溶液温度升高到t2℃,则三种溶液的溶质质量分数大小关系是( )

