题目内容
 (2011?日照)某公司生产出的纯碱产品中经检测只含有氯化钠杂质.为测定产品中碳酸钠的质量分数,20℃时,称取该产品样品26.5g,加入到盛有一定质量稀盐酸的烧杯中,碳酸钠与稀盐酸恰好完全反应,气体完全逸出,得到不饱和NaCl溶液.反应过程用精密仪器测得烧杯内混合物的质量(m)与反应时间(t)关系如下图所示.
(2011?日照)某公司生产出的纯碱产品中经检测只含有氯化钠杂质.为测定产品中碳酸钠的质量分数,20℃时,称取该产品样品26.5g,加入到盛有一定质量稀盐酸的烧杯中,碳酸钠与稀盐酸恰好完全反应,气体完全逸出,得到不饱和NaCl溶液.反应过程用精密仪器测得烧杯内混合物的质量(m)与反应时间(t)关系如下图所示.求:
(1)生成CO2的质量.
(2)该纯碱样品中Na2CO3的质量分数.
(3)根据条件,此题还可求算出下列中的______(只填字母标号,不计算,可多选).
A.该纯碱样品中NaCl的质量分数; B.反应所用稀盐酸的溶质质量分数;
C.反应后所得溶液中NaCl的质量分数; D.反应生成水的质量.
【答案】分析:(1)样品中只有碳酸钠可与稀盐酸反应放出二氧化碳,因此恰好完全反应前后烧杯内混合物的质量差即为放出二氧化碳气体的质量;
(2)根据反应的化学方程式,由生成二氧化碳气体的质量计算出样品中碳酸钠的质量,碳酸钠的质量与样品的质量比可计算样品中碳酸钠的质量分数;
(3)审题时要注意给出的纵坐标是烧杯中物质的总质量,而不包含烧杯.
解答:解:(1)根据质量守恒定律,生成二氧化碳的质量为172.5g-163.7g=8.8g
(2)设:样品中碳酸钠的质量为x
Na2CO3+2HCl═2NaCl+CO2↑+H2O
106 44
x 8.8g
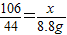 x=
x=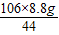 =21.2g
=21.2g
则该纯碱样品中碳酸钠的质量分数为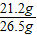 ×100%=80%
×100%=80%
答:(1)生成二氧化碳的质量8.8g;(2)该纯碱样品中Na2CO3质量分数为80%.
(3)A、利用样品质量与碳酸钠质量差即可求得样品中氯化钠的质量,氯化钠质量与样品质量比可计算样品中氯化钠的质量分数;故A正确;
B、根据反应的化学方程式,由二氧化碳质量可计算稀盐酸中HCl中质量;所加入稀盐酸溶液的质量172.5g-26.5g=146g,可以计算出反应所用稀盐酸的溶质质量分数;故B正确;
C、虽然可通过计算确定反应后所得氯化钠溶液中氯化钠的质量,题目说的是烧杯内物质的质量,所得溶液的质量就为163.7g,且其中没有不溶解于水的杂质存在.所以可以计算所得溶液的溶质的质量分数;故C正确;
D、根据反应的化学方程式,由生成二氧化碳的质量可计算出生成水的质量;故D正确;
故答案为:ABCD.
点评:在对变化的曲线进行分析时,曲线的折点意味着恰好完全反应,此时总质量与反应前总质量的差即为反应放出气体的质量.
(2)根据反应的化学方程式,由生成二氧化碳气体的质量计算出样品中碳酸钠的质量,碳酸钠的质量与样品的质量比可计算样品中碳酸钠的质量分数;
(3)审题时要注意给出的纵坐标是烧杯中物质的总质量,而不包含烧杯.
解答:解:(1)根据质量守恒定律,生成二氧化碳的质量为172.5g-163.7g=8.8g
(2)设:样品中碳酸钠的质量为x
Na2CO3+2HCl═2NaCl+CO2↑+H2O
106 44
x 8.8g
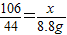 x=
x=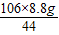 =21.2g
=21.2g则该纯碱样品中碳酸钠的质量分数为
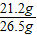 ×100%=80%
×100%=80%答:(1)生成二氧化碳的质量8.8g;(2)该纯碱样品中Na2CO3质量分数为80%.
(3)A、利用样品质量与碳酸钠质量差即可求得样品中氯化钠的质量,氯化钠质量与样品质量比可计算样品中氯化钠的质量分数;故A正确;
B、根据反应的化学方程式,由二氧化碳质量可计算稀盐酸中HCl中质量;所加入稀盐酸溶液的质量172.5g-26.5g=146g,可以计算出反应所用稀盐酸的溶质质量分数;故B正确;
C、虽然可通过计算确定反应后所得氯化钠溶液中氯化钠的质量,题目说的是烧杯内物质的质量,所得溶液的质量就为163.7g,且其中没有不溶解于水的杂质存在.所以可以计算所得溶液的溶质的质量分数;故C正确;
D、根据反应的化学方程式,由生成二氧化碳的质量可计算出生成水的质量;故D正确;
故答案为:ABCD.
点评:在对变化的曲线进行分析时,曲线的折点意味着恰好完全反应,此时总质量与反应前总质量的差即为反应放出气体的质量.

练习册系列答案
相关题目
(2011?日照)KNO3和KCl在不同温度时的溶解度如下表所示.请回答下列问题:
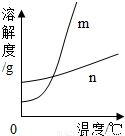
(1)依据上表数据,绘制KNO3和KCl的溶解度曲线,右图中能表示KNO3溶解度曲线的是.(填m或n)
(2)由表中数据分析可知,KNO3和KCl在某一温度时具有相同的溶解度x,则x的取值范围是.
(3)10℃时,131g 饱和KCl溶液,蒸发10g水后,再降温到10℃,可析出KCl晶体的质量为.
(4)如右图所示,20℃时,将盛有饱和KNO3溶液的小试管放入盛水的烧杯中,向水中加入某物质后,试管中有晶体析出.加入的物质可能是下列中的(填字母序号).
A.氢氧化钠固体 B.生石灰固体 C.冰块
D.硝酸铵固体 E.浓硫酸.
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | 70 | ||
| 溶解度/g | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 |
| KCl | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | 48.3 | |
(2)由表中数据分析可知,KNO3和KCl在某一温度时具有相同的溶解度x,则x的取值范围是.
(3)10℃时,131g 饱和KCl溶液,蒸发10g水后,再降温到10℃,可析出KCl晶体的质量为.
(4)如右图所示,20℃时,将盛有饱和KNO3溶液的小试管放入盛水的烧杯中,向水中加入某物质后,试管中有晶体析出.加入的物质可能是下列中的(填字母序号).

A.氢氧化钠固体 B.生石灰固体 C.冰块
D.硝酸铵固体 E.浓硫酸.

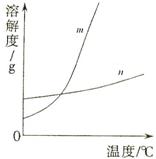 (1)依据上表数据,绘制KNO3和KCl的溶解度曲线,右图中能表示KNO3溶解度曲线的是
(1)依据上表数据,绘制KNO3和KCl的溶解度曲线,右图中能表示KNO3溶解度曲线的是