��Ŀ����
����Ŀ�������ڷ�����ѧ��ӦʱҪ��ѭ�����غ㶨�ɡ��ס�������ͬѧ�Ӳ�ͬ�ĽǶ� �о��������غ㶨�ɡ�
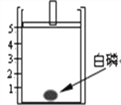
(1)����ͬѧ���������ͼʵ�飬ͼ���Լ����ǰ�����ʵ��������ֱ��ʾΪ m(ǰ)��m(��)�� �����ͼʾ�ش� ����ʵ���У�m(ǰ)>m(��)��ԭ����_____���������Լ����䣬�Ľ��� ������_________�� ���۵ĽǶȷ�������ѧ�仯�д��������غ㶨�ɵı���ԭ����_____��
(2)����ͬѧ�о������� W ����ɡ�һ�������£�W ���ܱ������ڷ�����Ӧǰ�������
����������ͼ��ʾ��
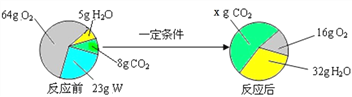
���У�x=_____g�� W �Ļ�ѧʽ��_____��
(3)һ�������£����ҷ�Ӧ���ɱ��Ͷ�(�������ʾ��ɷ��ӹ���)����Ӧǰ����ʾ ��ͼ���¡�����˵����ȷ����_____(��ѡ��)��
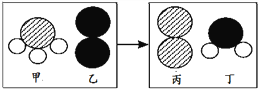
A����Ӧǰ���� 4 ��ԭ��
B���÷�Ӧ�е�������
C����Ӧǰ��Ԫ�ػ��ϼ۶�����
D����ѧ�仯�з��Ӻ�ԭ�Ӿ����ٷ�
E�� �û�ѧ��Ӧ�У��ס������ַ��ӵĸ������� 2��3
���𰸡� �ڱֿ������ڷ�Ӧ�������� CO2 ��ɢ�������� ����Ӧ�����ܱ������ڽ��� ��ѧ ��Ӧǰ��ԭ�����ࡢ��Ŀ������������ 52 C2H6O BE
����������������������⿼���������غ㶨�ɵ�̽������ʵ�ʡ��μӻ�ѧ��Ӧ�ĸ����������ܺ͵��ڷ�Ӧ�����ɵĸ����������ܺͣ������ڷ�����ѧ��Ӧʱ��Ӧ���������С�����������������࣬�жϷ�Ӧ�����������д����Ӧ�ı���ʽ��
��1��������װ���dz��ڵ�װ�ã������Ķ�����̼���ձ�����ɢ��ȥ�����������٣��Ľ���װ�õķ����ǣ�����Ӧ�����ܱ������ڽ�����
��2�����۵ĽǶȷ�������ѧ�仯�д��������غ㶨�ɵı���ԭ���ǻ�ѧ��Ӧǰ��ԭ�����ࡢ��Ŀ�����������䡣
��3����������������W������������С�������Ƿ�Ӧ��ҷ�Ӧ�����������23g+��64g��16g��=71g����ˮ���������ӣ�������ֵ��32g��5g=27g�����������غ㶨�ɲμӻ�ѧ��Ӧ�ĸ����������ܺ͵��ڷ�Ӧ�����ɵĸ����������ܺͣ����Զ�����̼���������������ɵ�������71g��27g=44g���˷�Ӧ�ı���ʽ�ɱ�ʾΪW+O2��CO2+H2O�������Ϸ���֪X��ֵ����44g+8g=52g��
�ȸ��ݷ�Ӧǰ��Ԫ�ص�����䣬ȷ����w��һ������̼��������Ԫ�أ����ܺ�����Ԫ�أ��ٸ��ݷ�Ӧǰ��Ԫ�ص�������ȣ���ȷ����Ԫ���Ƿ��У�44g������̼��̼Ԫ�ص�����=44g��![]() =12g��32g��5g=27gˮ����Ԫ�ص�����=27g��
=12g��32g��5g=27gˮ����Ԫ�ص�����=27g��![]() =3g��������̼����Ԫ�ص�����Ϊ��44g��12g=32g��ˮ����Ԫ�ص�����Ϊ��27g��3g=24g���ʷ�ӦǰӦ����Ԫ�ص�����Ϊ��32g+24g=56g�����μӷ�Ӧ������������Ԫ��64��12=48g����w��Ӧ����56��48=8g����Ԫ�أ���w��̼���⡢������Ԫ�ص�������Ϊ��12��3��8��̼���⡢������Ԫ�ص�ԭ�Ӹ�����Ϊ
=3g��������̼����Ԫ�ص�����Ϊ��44g��12g=32g��ˮ����Ԫ�ص�����Ϊ��27g��3g=24g���ʷ�ӦǰӦ����Ԫ�ص�����Ϊ��32g+24g=56g�����μӷ�Ӧ������������Ԫ��64��12=48g����w��Ӧ����56��48=8g����Ԫ�أ���w��̼���⡢������Ԫ�ص�������Ϊ��12��3��8��̼���⡢������Ԫ�ص�ԭ�Ӹ�����Ϊ![]() ��
�� ![]() ��
�� ![]() �� =2��6��1����w�Ļ�ѧʽΪ��C2H6O��
�� =2��6��1����w�Ļ�ѧʽΪ��C2H6O��
��3������ͼʾ�ķ��ӽṹ��֪�÷�Ӧ�Ļ�ѧ����ʽ����Ϊ��4AB3+3C2 =2A2+6B2C����
A���ɷ���ʽ��֪����Ӧǰ��һ����3��ԭ�ӣ���A����
B���ɷ���ʽ��֪���÷�Ӧ�е���A2���ɣ���B��ȷ��
C���÷�Ӧ�е���A2���ɣ�Ԫ���ڵ����л��ϼ�Ϊ�㣬�ʷ�Ӧǰ��һ���л��ϼ۵ı仯����C����
D�������ı仯��֪����ѧ�仯�з��ӿ��ٷ֣�ԭ�Ӳ����ٷ֣���D����
E���ɷ���ʽ��֪���Ͷ����ַ��ӵĸ�������2��3����E��ȷ��

 ����������������ϵ�д�
����������������ϵ�д�