题目内容
【题目】我国制碱工业先驱侯德榜发明了“侯氏制碱法”.其模拟流程如下:
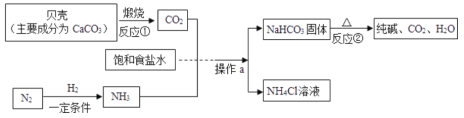
(1)反应①的基本反应类型是___,反应②的化学方程式为______。
(2)工业上利用氮气和氧气的___不同,把氮气从液态空气中分离出来。
(3)为了提高产率,往饱和食盐水中通入气体,应该先通入__(填“NH3”或“CO2”),操作a的名称是__。
(4)在生产过程中可以循环利用的物质是___。
【答案】分解反应 ![]() 沸点 NH3 过滤 二氧化碳和水 (只答二氧化碳也给分)
沸点 NH3 过滤 二氧化碳和水 (只答二氧化碳也给分)
【解析】
碳酸钙在高温条件下分解生成氧化钙和二氧化碳,碳酸氢钠受热分解生成碳酸钠、水和二氧化碳,氨气在水中的溶解度较大。
(1)反应①是碳酸钙高温生成氧化钙和二氧化碳,反应符合一变多,故反应的基本反应类型是分解反应,反应②是碳酸氢钠加热生成碳酸钠、水和二氧化碳,反应的化学方程式为![]() 。
。
(2)氮气沸点比氧气沸点低,加热时氮气先从液态空气中蒸发出来,故工业上利用氮气和氧气的沸点不同,把氮气从液态空气中分离出来。
(3)氨气在水中的溶解度大,先通氨气会吸收更多的二氧化碳,有利于生成较多的碳酸氢钠,故为了提高产率,往饱和食盐水中通入气体,应该先通入NH3,操作a是将固体和液体分离,故名称是过滤。
(4)碳酸氢钠受热分解产生二氧化碳和水,二氧化碳和水均可作为流程中的反应物,故在生产过程中可以循环利用的物质是二氧化碳和水。

 阅读快车系列答案
阅读快车系列答案【题目】如图所示,某兴趣小组在进行酸碱中和反应的实验探究时,向烧杯中氢氧化钠溶液中滴加稀盐酸一会儿后,发现忘记滴加指示剂,甲同学从烧杯中取少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色,请写出该中和反应方程式:___________
(1)猜想与假设:
猜想一:甲同学:“两种物质已恰好完全中和,溶液呈中性”;
猜想二:乙同学:“反应后氢氧化钠过量,溶液呈碱性”;
猜想三:丙同学:___________
甲、丙两位同学经过讨论后觉得乙同学的猜想不正确,两位同学的理由是:______________
(2)设计并进行实验:
①为了验证自己的猜想,甲同学设计了以下实验方案:
实验步骤 | 实验现象 | 实验结论 |
用洁净干燥的玻璃棒蘸取少量反应后的溶液滴在干燥的pH试纸上,观察颜色变化并与标准比色卡对比. | pH______(填“>”、“=”或“<”)7 | 猜想一不成立 |
②请设计另一个实验(与甲同学方案不同)方案,验证丙同学的猜想,并填写下表:
实验步骤 | 实验现象 | 实验结论 |
_________ | _______ | 猜想三成立 |
【题目】下表列出了除去物质中所含少量杂质的方法,其中错误的是![]()
选项 | 物质 | 杂质 | 除杂方法 |
A | O2 | 水蒸气 | 通过足量的浓硫酸 |
B | Cu粉 | Fe粉 | 磁铁吸引 |
C | CO2 | CO | 点燃 |
D | NaCl溶液 | Na2CO3 | 滴入稀盐酸至刚好不再产生气泡 |
A.AB.BC.CD.D
【题目】如表为氯化钠和氯化铵在不同温度时的溶解度,请回答下列问题。
温度/°C | 0 | 10 | 20 | 30 | 40 | 50 |
NH4Cl溶解度/g | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 49.6 |
NaC1溶解度/g | 35.4 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
(1)由表中数据可知,溶解度随温度变化较大的物质是_____。
(2)20°C时,100g水最多能溶解NaC1_____g;
(3)向烧杯中加入100g水和49.0g氯化铵配成50°C的溶液,此时溶液为_____溶液(填“饱和”或“不饱和”);再冷却到20°C,烧杯中析出固体的质量为_____g;另外多角度看物质,有助于加深对物质的认识。Na2CO3是一种常见的盐,请回答:
(4)Na2CO3溶液显碱性,其pH_____7(填“<”、“>”或“=”);
(5)Na2CO3可看成是碱和氧化物反应的产物,写出反应的化学方程式_____。
(6)Na2CO3作为反应物之一,写出一个符合![]() 形式的化学方程式_____。
形式的化学方程式_____。
【题目】寒假期间,小英对碳酸钠和稀盐酸滴加顺序不同产生的异常现象进行了探究。
现象一:将碳酸钠滴到稀盐酸中有大量气泡产生。
探究一:该气体的成分 。
[设计实验]将生成的气体通过澄清的石灰水,实验现象是____。
小英据此判断生成物中含有二氧化碳。
[得出结论]写出碳酸钠滴入稀盐酸中发生反应的化学方程式____。
现象二:将少量稀盐酸滴入碳酸钠溶液中没有气泡产生。
[查阅资料]当稀盐酸较少时,与碳酸钠反应会生成碳酸氢钠,碳酸氢钠显碱性。碳酸氢钠与氯化钡混合无明显现象。
探究二:是否有碳酸氢钠生成。
[进行实验]
实验编号 | 实验现象 | 实验操作 |
① | 取反应后的液体滴加过量的氯化钡溶液 | 有___生成 |
② | 取上层清液滴加_____ | 溶液由无色变成红色 |
[得出结论]
(1)实验①中加入过量氯化钡的目的是___,为确认加入的氯化钡溶液已经足量,还应该进行的实验步骤是______。
(2)由实验能确定反应生成了碳酸氢钠,理由是______。
[评价反思]①实验室有两瓶无标签试液,分别是稀盐酸和碳酸钠溶液,有同学认为不使用其他试剂也可以鉴别,其方法是(写出操作步骤、实验现象和结论)。_____。
⑦上述反应说明反应物的量不同生成物不同,比如碳和氧气反应也是这样。请再举一例,说明反应条件不同生成物不同(用文字或化学方程式表达)。______。