题目内容
【题目】将5.85gNaCl固体溶于108.5g水中,得到不饱和溶液,再向所得溶液中滴入200gAgNO3溶液。实验过程中,生成NaCl的质量与滴入的AgNO3溶液的关系如下图所示
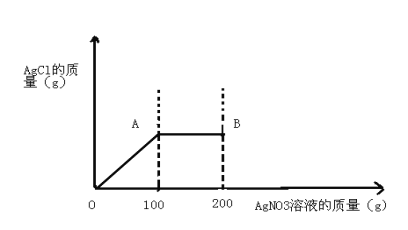
(1)计算A点处消耗AgNO3的质量?
(2)计算B点溶液中AgNO3的溶质质量分数?
【答案】(1)17g(2)5.7%
【解析】
试题分析:观察图像中的数据,注意抓住起始点、转折点,尤其是转折点:表示某一个反应的结束;故从该图像可看出A点表示反应结束,所消耗得硝酸银溶液质量为100g,故可根据化学方程式:NaCl+AgNO3=AgCl↓+NaNO3中NaCl与AgCl、AgNO3质量关系
解:设AgNO3的质量为X,生成AgCl质量为Y
从图看出,反应结束,AgNO3溶液的质量只消耗一半
NaCl + AgNO3= AgCl ↓ + NaNO3
58.5 170 143.5
5.85g x y
(1)58.5:170=5.85g:x x=17g
58.5:143.5=5.58g:y y=14.35 g
(2)反应后溶液中AgNO3的质量剩下同样为17g
反应后的总溶液:5.85+108.5+200—14.4 =300 g
(17÷300)×100﹪=5.7﹪

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目

