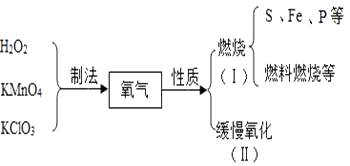
题目内容
【题目】某兴趣小组同学对实验室制备氧气的若干问题进行如下实验探究。
(1)为探究催化剂的种类对氯酸钾分解速度的影响,甲同学设计以下对比实验:
Ⅰ.将2.45 g KClO3与1.0 g MnO2均匀混合加热
Ⅱ.将 x g KClO3与1.0 g CuO均匀混合加热
在相同温度下,比较两组实验产生O2的快慢。通常采用的方法有:
① 测相同时间内产生O2的体积
② 测;
Ⅰ中反应的符号表达式是;
Ⅱ中x的值应为。
(2)乙同学探究了影响双氧水分解速度的某种因素,实验数据记录如表:
双氧水的质量 | 双氧水的浓度 | MnO2的质量 | 相同时间内 | |
I | 50.0g | 1% | 0.1g | 9mL |
II | 50.0g | 2% | 0.1g | 16mL |
III | 50.0g | 4% | 0.1g | 31mL |
【数据处理及结论】
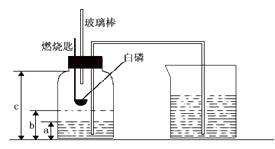
I.本实验中,测量O2体积的装置是(选填下图1中“a”“b”“c”编号)。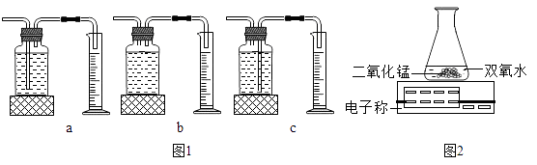
II.实验结论:在相同条件下, , 双氧水分解速率越快。
III.丙用如图2装置进行实验,通过比较也能达到实验目的,写出锥形瓶中发生反应的符号表达式 。
【答案】
(1)测得产生相同体积的氧气需要的时间,2KClO3 ![]() 2KCl+3O2↑,2.45克
2KCl+3O2↑,2.45克
(2)C,双氧水浓度越大,单位时间内质量的变化,2H2O2 ![]() 2H2O +O2↑
2H2O +O2↑
【解析】为探究催化剂的种类对氯酸钾分解速度的影响,甲同学设计以下对比实验:在相同温度下,比较两组实验产生O2的快慢。通常采用的方法有:①测相同时间内产生O2的体积② 测测得产生相同体积的氧气需要的时间,来看催化剂的作用;Ⅰ中反应的符号表达式是2KClO3 ![]() 2KCl+3O2↑;Ⅱ中x的值应为2.45克,因为比较催化剂的效果就要把其他条件都保持一致,本实验中,测量O2体积的装置是C,利用压力将水压入量筒内,来测定气体的体积,实验结论:在相同条件下,双氧水浓度越大,双氧水分解速率越快。如图2装置进行实验,通过比较单位时间内质量的变化也能达到实验目的,锥形瓶中发生反应的符号表达式 2H2O2
2KCl+3O2↑;Ⅱ中x的值应为2.45克,因为比较催化剂的效果就要把其他条件都保持一致,本实验中,测量O2体积的装置是C,利用压力将水压入量筒内,来测定气体的体积,实验结论:在相同条件下,双氧水浓度越大,双氧水分解速率越快。如图2装置进行实验,通过比较单位时间内质量的变化也能达到实验目的,锥形瓶中发生反应的符号表达式 2H2O2 ![]() 2H2O +O2↑。
2H2O +O2↑。
【考点精析】本题主要考查了催化剂的特点与催化作用和书写化学方程式、文字表达式、电离方程式的相关知识点,需要掌握催化剂(触媒):在化学反应中能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质.(一变两不变)催化剂在化学反应中所起的作用叫催化作用;注意:a、配平 b、条件 c、箭号才能正确解答此题.

 学习实践园地系列答案
学习实践园地系列答案【题目】对下列实验指定容器中的水,其解释没有体现水的主要作用的是 ( )
A. | B. | C. | D. | |
实验 |
|
|
|
|
解释 | 集气瓶中的水: | 量筒中的水: | 集气瓶中的水: | 集气瓶中的水:先将集气瓶内的空气排净,后便于观察氧气何时收集满 |
A.A
B.B
C.C
D.D
【题目】下列为实验室常用的实验装置,回答问题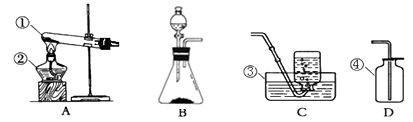
(1)请写出有标号仪器的名称:②;③。
(2)实验室用高锰酸钾制氧气应选用的发生装置是(填序号),装入药品前应先;如用C装置收集O2 , 则气体收集完毕时,应先 , 如果用上述装置收集到的氧气不纯,可能的原因是 , 高锰酸钾制氧气反应的文字表达式是。
(3)实验室制CO2反应文字表达式为 ;此外,也可用加热碳酸氢钠(NaHCO3)固体(产物为碳酸钠、二氧化碳、水)来制取CO2 , 该反应应选用的发生装置为 , 收集宜用装置。实验室不可用加热碳酸氢铵固体来制取CO2的原因是。
(4)若用右图E装置收集氧气应从处进气(填“a”或“b”);检验已收满的方法是 , 若在E中装满水用排水法来收集氧气应从处进气。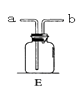
(5)用B制取氧气比A制取氧气的优点是(填编号)。
A.生成物只有氧气
B.反应不需加热节能
C.便于控制反应速率
D.生成物对环境没有污染
(6)某科学兴趣小组学习二氧化锰(MnO2)催化分解过氧化氢的实验后,进行如下实验:a. 选择装置并检查气密性。b.称取0.1克的二氧化锰(MnO2)粉末加入容器中。c.量取50毫升溶质质量分数约5%的过氧化氢溶液加入容器中,记录一定时间内收集到的气体体积。改变二氧化锰的质量,重复上述实验,记录数据如下。(溶解到水中的氧气忽略不计)
时间/秒 | 生成氧气的体积/毫升 | |||
0.1克MnO2 | 0.2克MnO2 | 0.3克MnO2 | 0.4克MnO2 | |
40 | 49 | 61 | 75 | 86 |
80 | 77 | 87 | 90 | 92 |
120 | 89 | 92 | 92 | 92 |
160 | 92 | 92 | 92 | 92 |
①写出过氧化氢溶液与二氧化锰混合物制取氧气反应的文字或符号表达式。
②该学习小组利用上述发生装置中的(填“A”或“B”)与下列装置中的(填编号)连接测量O2的体积。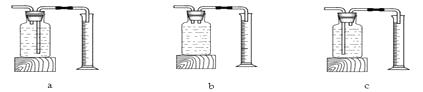
③实验结论:在相同条件下, , 双氧水分解得越快。
④实验反思:由上述实验测得的氧气体积总是偏大的可能原因是。