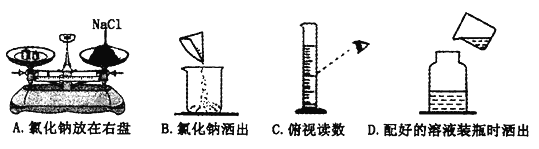
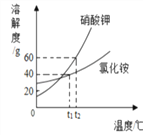
题目内容
【题目】向一定质量FeCl2和Cu Cl2的混和溶液中,逐渐加入足量的锌粒。下图是反应过程中氯化亚铁的质量变化情况。
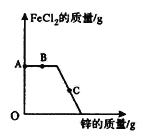
(1)B点时,反应的化学方程式是_________________。
(2)C点时,溶液中的溶质有_________________。
(3)C点与A点相比,溶液质量增加的原因是_________________。
【答案】 Zn + CuCl2 == ZnCl2 + Cu 氯化锌、氯化亚铁(或用化学式表示) 反应生成的氯化锌的质量大于参加反应的氯化铜和氯化亚铁的质量
【解析】在金属活动性顺序中,金属的活动性强弱是:锌>铁>氢>铜,在FeCl2和CuCl2的混合物溶液中加入一定量的锌,锌先与氯化铜溶液反应生成氯化锌溶液和铜,氯化铜完全反应后,若还有锌,锌才能与氯化亚铁溶液反应生成氯化锌溶液和铁;
Zn+CuCl2=ZnCl2+Cu溶液增量
65 646564=1
Zn+FeCl2=ZnCl2+Fe溶液增量
65 56 6556=9(1)B点时,是锌与氯化铜反应,生成氯化锌和铜,反应的化学方程式是Zn + CuCl2 == ZnCl2 + Cu;(2)C点时氯化亚铁还有剩余,此时是锌与氯化亚铁反应,氯化铜已经完全反应,所以溶液中的溶质有氯化锌、氯化亚铁;(3)有以上分析可知,C点与A点相比,溶液质量增加的原因是反应生成的氯化锌的质量大于参加反应的氯化铜和氯化亚铁的质量。

练习册系列答案
相关题目