题目内容
 (2007?岳阳)图所示为实验室浓盐酸试剂瓶标签的部分内容.请解答下列问题:
(2007?岳阳)图所示为实验室浓盐酸试剂瓶标签的部分内容.请解答下列问题:(1)未启封的试剂瓶中浓盐酸的质量应是
600
600
g.(2)取该浓盐酸50mL,可配制成10%的盐酸
228
228
g.现有10mL和100mL两种规格的量筒,量取这些浓盐酸时,应选用100
100
mL的量筒.(3)实验桌上有一瓶标注为l0%的稀盐酸,可能因为配制时计量不准而造成质量分数误差.某同学取该稀盐酸20g,与足量的锌完全反应,制得0.04gH2.试通过计算,判断该试剂瓶上标注的质量分数是否准确.(要求写出计算过程)
分析:(1)根据体积、密度、质量的关系进行计算;
(2)根据稀释前后溶质不变列等式进行计算.
(3)根据氢气的质量求出氯化氢的质量,从而求出盐酸的溶质质量分数,与标注的数值比较即可
(2)根据稀释前后溶质不变列等式进行计算.
(3)根据氢气的质量求出氯化氢的质量,从而求出盐酸的溶质质量分数,与标注的数值比较即可
解答:解:(1)瓶内浓盐酸的质量为:500mL×1.2g/mL=600g;
(2)设稀释成10%的盐酸溶液的质量为x.
50mL×1.2g/mL×38%=x×10%
x=228g
(3)设生成0.04g氢气需要氯化氢质量为y
Zn+2HCl═ZnCl2+H2↑
73 2
y 0.04g
=
y=1.46g
此稀盐酸的溶质质量分数=
×100%=7.3%<10%,因此该试剂瓶上标注的质量分数不准确.
故答案为:
(1)600g;(2)228.(3)不准确
(2)设稀释成10%的盐酸溶液的质量为x.
50mL×1.2g/mL×38%=x×10%
x=228g
(3)设生成0.04g氢气需要氯化氢质量为y
Zn+2HCl═ZnCl2+H2↑
73 2
y 0.04g
| 73 |
| y |
| 2 |
| 0.04g |
此稀盐酸的溶质质量分数=
| 1.46g |
| 20g |
故答案为:
(1)600g;(2)228.(3)不准确
点评:通过回答本题要知道利用标签中所给信息做题的方法,不要忽略标签中任何数据,溶液质量=溶液体积×密度.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (2007?岳阳)图是甲、乙两种固体物质的溶解度曲线,下列说法正确的是( )
(2007?岳阳)图是甲、乙两种固体物质的溶解度曲线,下列说法正确的是( )
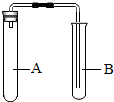 (2007?岳阳)为了验证鸡蛋壳的主要成分是CaCO3,盛莉同学进行了以下实验探究:
(2007?岳阳)为了验证鸡蛋壳的主要成分是CaCO3,盛莉同学进行了以下实验探究: