题目内容
下列物质放入水中,能形成溶液的是( )
A. 石灰石 B. 纯碱 C. 汽油 D. 面粉
 名校课堂系列答案
名校课堂系列答案某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究.
[查阅资料]
<资料1>该厂采用“侯氏制碱法”生产的化工产品为纯碱(化学式为_____)和氯化铵.(“侯氏制碱法”是我国近代著名科学家侯德榜发明的一种连续生产纯碱与氯化铵的联合制碱工艺.)
<资料2>生产原料粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质.
<资料3>部分生产流程如下图所示.
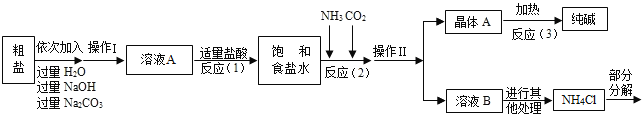
上述流程中涉及的部分反应的化学方程式为:MgCl2+2NaOH=Mg(OH)2↓+2NaCl;Na2CO3+CaCl2=CaCO3↓+2NaCl;NH4Cl═NH3↑+HCl↑
生产原理:将氨气(NH3)和二氧化碳通入饱和食盐水中得到小苏打和氯化铵的混合物,其反应的化学方程式为:NaCl(饱和溶液)+NH3+CO2+H2O=NaHCO3(晶体)↓+NH4Cl;分离出NaHCO3,使其充分受热即可分解制得纯碱及两种常见的氧化物,此反应的化学方程式为_____.
(问题讨论)
(1)溶液A中的溶质为_____,操作Ⅱ的名称为_____.
(2)上述生产流程中可循环使用的是_____(填序号).
ACO2BNH3C.HCl DNaOH ENa2CO3
(3)根据上述信息,请你设计实验区分碳酸钠和碳酸氢钠.
实验步骤 | 实验现象 | 实验结论 |
_____ | _____ | _____ |
(含量测定)
同学们为了测定该纯碱样品的纯度,设计了如下实验.
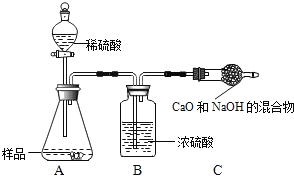
甲组:取10.0g纯碱样品(假定杂质在整个实验过程中不发生变化),向其中加入过量的盐酸,直至样品中无气泡冒出.充分加热蒸发所得物质并干燥、冷却至室温后称量,所得固体质量为10.9g.样品中碳酸钠的质量分数为_____(结果保留一位小数).
乙组:取10.0g纯碱样品,利用右图所示装置,测出反应后装置C增重了3.5g(所加试剂均足量).
实验结束后,发现乙组测定的质量分数偏小,其原因是_____.
乙烯(C2H4)是石油炼制的重要产物之一.常温常压时,乙烯是一种气体,它与另一种气体组成的混合物中碳元素的质量分数为87%,则另一种气体可能是( )
A. H2 B. CH4 C. C2H2 D. CO
下列实验中物质鉴别利用提供的方案不能达到目的是( )
选项 | 物质鉴别 | 实验方案 |
A | 水和过氧化氢溶液 | 加入二氧化锰,观察有无气泡冒出 |
B | 鉴别氮气和氧气 | 将带火星的木条插入集气瓶中,看是否复燃 |
C | 硬水和软水 | 加入肥皂水 |
D | CO 和 CO2 | 闻气味 |
A. A B. B C. C D. D