题目内容
【题目】某化学活动小组在一次实验中进行了如图所示的实验:(即:往盛有碳酸钠溶液的U形玻璃管左边中滴入氯化钡溶液,在右边滴入氢氧化钡溶液)此时观察到的实验现象是________。
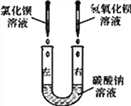
实验后,小组同学充分振荡U形玻璃管,将U形玻璃管内的物质过滤后,对滤液成分产生了浓厚的兴趣,进行了进一步的探究活动。
【提出问题】滤液中除Na+外,还含有什么离子?
【猜想与假设】
A同学:含有OH-、Cl-、CO![]()
B同学:含有OH-、Cl-、Ba2+
C同学:含有________________(填离子符号)
【实验探究】B同学为了验证自己的猜想,取少量滤液于试管中,向其中滴加少量的硫酸钠溶液,观察到无明显现象。由此B同学得出结论:自己的猜想不成立,A同学的猜想成立
【评价与交流】
请你评价B同学的结论并说明理由:___________________
【实验探究】 C同学选择了另一种试剂进行实验,确定了滤液中的离子成分
实验步骤 | 实验现象 | 实验结论 |
取少量滤液,向其中加入足量的________ (填化学式) | ______________ | A同学猜想正确 |
【答案】 白色沉淀(或白色浑浊) OH-、Cl- 不正确,加入硫酸钠溶液,无明显现象,只能说明溶液中无Ba2+,但无法证明溶液中一定含有CO![]() ,即C同学的猜想也有可能 H2SO4 有气泡产生
,即C同学的猜想也有可能 H2SO4 有气泡产生
【解析】(1)碳酸钠能与氯化钡反应生成碳酸钡沉淀和氯化钠,能与氢氧化钡反应生成碳酸钡沉淀和和氢氧化钠,故可观察到的现象是产生白色沉淀;(2)由反应的化学方程式可知反应后生成了氯化钠和氢氧化钠,故一定含有钠离子、氢氧根离子和氯离子,若存在反应物过量的问题,那么还可能存在钡离子或者是碳酸根离子,故C同学的猜想是OH-、Cl-;(3)由于硫酸钠只能和氯化钡反应生成硫酸钡沉淀,故只能检验出钡离子,即B同学的结论不正确,即加入硫酸钠溶液,无明显现象,只能说明溶液中无Ba2+,但无法证明溶液中是否一定含有CO![]() ,即C同学的猜想也有可能;(4)A 同学的猜想正确,即要证明溶液中含有碳酸根离子,故可向溶液中加入稀硫酸,若含有碳酸根离子,那么会生成二氧化碳,即观察到产生大量气泡的现象。
,即C同学的猜想也有可能;(4)A 同学的猜想正确,即要证明溶液中含有碳酸根离子,故可向溶液中加入稀硫酸,若含有碳酸根离子,那么会生成二氧化碳,即观察到产生大量气泡的现象。

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案【题目】一水泥厂为测定某批石灰石中含碳酸钙的质量分数,称取了12.5g石灰石样品并敲碎,进行了四次高温煅烧(假设其中的固体杂质既没有变化,也没损失).剩余固体质量的数据记录如表:
煅烧次数 | 第一次 | 第二次 | 第三次 | 第四次 |
剩余固体质量 | 11.1g | 8.7g | 8.1g | 8.1g |
(注:石灰石煅烧的化学方程式为CaCO3![]() CaO+CO2↑)
CaO+CO2↑)
试计算:
(1)煅烧第______次时,石灰石已完全分解.
(2)石灰石样品中碳酸钙的质量分数____________.