题目内容
【题目】酸和碱是初中阶段两类非常重要的化合物。
(1)实验考查时,需要配置5%的氢氧化钠溶液100g,量取该实验所需水的体积时,需要选用的合适的仪器是_____。
(2)经检测,所配制溶液的溶质质量分数偏小,其原因可能是_____(填序号)。
①氢氧化钠固体不纯 ②装瓶时,有少量溶液洒出 ③量取水时,仰视读数
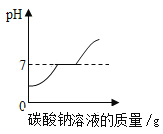
(3)如图所示,某校化学小组在利用盐酸和氢氧化钠溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图像。滴加的顺序有两种:
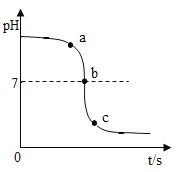
①是将氢氧化钠溶液滴加到盐酸中;
②是将盐酸滴加到氢氧化钠溶液中。
据图像分析你认为是_____(填“①”或“②”)。
某同学在滴加过程中,意外发现了有气泡产生,请写出产生气泡时,发生反应的化学方程式:_____。c点时溶液中的微粒有_____(用符号表示)。
(4)某已变质的氢氧化钠溶液100g,向其中加入溶质质量分数为7.3%的稀盐酸100g,恰好完全反应得到中性溶液。则蒸干该中性溶液可得到固体的质量是_____。
【答案】量筒、胶头滴管 ①③ ② ![]()
![]() 11.7g
11.7g
【解析】
所配制溶液的溶质质量分数偏小,应该是氢氧化钠的质量偏小或水的体积偏大;
氢氧化钠变质生成碳酸钠,碳酸钠和盐酸反应生成氯化钠、水和二氧化碳。
(1)量取该实验所需水的体积时,需要选用的合适的仪器是量筒、胶头滴管。
(2)所配制溶液的溶质质量分数偏小,应该是氢氧化钠的质量偏小或水的体积偏大,氢氧化钠固体不纯,导致氢氧化钠质量偏小,装瓶时,有少量溶液洒出,不会影响溶液质量分数,量取水时,仰视读数,导致水的体积偏大,故选①③。
(3)根据图像,在反应未进行时,溶液的pH>7,为碱性溶液,所以该曲线反应是将盐酸滴入氢氧化钠溶液中,故选②;
氢氧化钠吸收空气中的二氧化碳会生成碳酸钠,碳酸钠与盐酸反应生成二氧化碳气体,反应的化学方程式为![]() ;
;
c点溶液的pH值小于7,盐酸过量,故c点时溶液中的微粒有![]() 。
。
(4)无论是氢氧化钠,还是碳酸钠,与稀盐酸反应都会生成氯化钠,由质量守恒定律可知,反应前后氯元素的质量不变。100g 7.3%的盐酸中所含氯化氢的质量为![]() ,其中氯元素的质量为
,其中氯元素的质量为![]() ,含7.1g氯元素需要氯化钠的质量为
,含7.1g氯元素需要氯化钠的质量为![]() 。
。

 中考解读考点精练系列答案
中考解读考点精练系列答案【题目】根据下表中氯化钠和碳酸钠在不同温度时的溶解度,判断下列说法不正确的是
温度/°C | 10 | 20 | 30 | 40 | |
溶解度/g | 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 |
碳酸钠 | 12.2 | 21.8 | 39.7 | 53.2 | |
A.氯化钠的溶解度曲线和碳酸钠的溶解度曲线交点温度在20℃~30℃之间
B.20℃时,在50g的水中加入12.2 g碳酸钠,充分搅拌后得到的是饱和溶液
C.20℃时,无法配制溶质质量分数超过26.5%的氯化钠溶液
D.氯化钠中混有少量碳酸钠,可以采用降温结晶的方法除去碳酸钠