题目内容
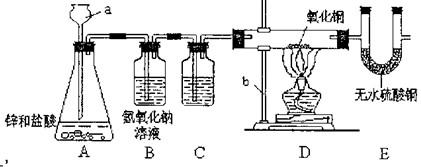
下图为制取、净化氢气并测定水的组成的一组实验装置,问: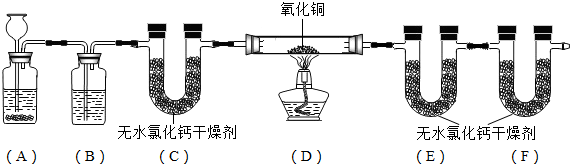
(1)为提供含杂质较少的氢气,装置(A)中加入的反应物应取第
①镁、盐酸 ②锌、稀硫酸
(2)因金属中含有杂质,反应时会生成少量硫化氢气体而干扰测定.已知硫化氢可溶于水,水溶液呈酸性,为除去硫化氢,在装置(B)中应加入
①氢氧化钠溶液 ②稀盐酸
(3)实验中,装置(D)中可观察到黑色的氧化铜粉末逐渐变为
(4)装置(C)、(E)、(F)的U型管内均装有无水氯化钙作为干燥剂,但它们起的作用均不相同,其中:装置(C)的作用是吸收氢气中含有的
(5)已知装置(D)氧化铜+玻璃管的质量在实验前为a克,实验后为b克;装置(E)氯化钙+U型管的质量在实验前为m克,实验后为n克.则测定水组成中氢元素和氧元素的质量比的计算式为
(6)如果装置(D)中玻璃管内装的粉末是CuO和Cu2O的混合物(Cu2O也可被H2还原为Cu,反应的方程式为Cu2O+H2
| ||
分析:(1)盐酸容易挥发,硫酸不容易挥发;
(2)显碱性的溶液能够吸收硫化氢气体;
(3)氧化铜是黑色的,铜是红色的;
(4)氯化钙能够吸收水;
(5)氧化铜+玻璃管的质量减少部分是生成的水中氧元素的质量,氯化钙+U型管的质量增大部分是反应生成的水的质量;
(6)玻璃管内装的粉末如果是CuO和Cu2O的混合物时,不影响实验结果.
(2)显碱性的溶液能够吸收硫化氢气体;
(3)氧化铜是黑色的,铜是红色的;
(4)氯化钙能够吸收水;
(5)氧化铜+玻璃管的质量减少部分是生成的水中氧元素的质量,氯化钙+U型管的质量增大部分是反应生成的水的质量;
(6)玻璃管内装的粉末如果是CuO和Cu2O的混合物时,不影响实验结果.
解答:解:(1)因为稀硫酸不容易挥发,用锌和稀硫酸反应时,生成的氢气中杂质较少.故填:②.
(2)用氢氧化钠溶液可以吸收硫化氢气体.故填:①.
(3)氢气还原氧化铜时,黑色的粉末逐渐变成红色.故填:红.
(4)装置(C)的作用是吸收氢气中含有的水.故填:水.
装置(F)的作用是:防止空气中的水分进入装置E中,影响测定结果.故填:防止空气中的水分进入装置E中,影响测定结果.
(5)由题意可知,生成的水中氧元素的质量为:ag-bg,水的质量为:ng-mg,则水中氢元素的质量为:ng-mg-ag+bg,则测定水组成中氢元素和氧元素的质量比的计算式为:
;故填:
.
(6)玻璃管内装的粉末如果是CuO和Cu2O的混合物时,不影响实验结果.故填:不变.
(2)用氢氧化钠溶液可以吸收硫化氢气体.故填:①.
(3)氢气还原氧化铜时,黑色的粉末逐渐变成红色.故填:红.
(4)装置(C)的作用是吸收氢气中含有的水.故填:水.
装置(F)的作用是:防止空气中的水分进入装置E中,影响测定结果.故填:防止空气中的水分进入装置E中,影响测定结果.
(5)由题意可知,生成的水中氧元素的质量为:ag-bg,水的质量为:ng-mg,则水中氢元素的质量为:ng-mg-ag+bg,则测定水组成中氢元素和氧元素的质量比的计算式为:
| n-m-a+b |
| a-b |
| n-m-a+b |
| a-b |
(6)玻璃管内装的粉末如果是CuO和Cu2O的混合物时,不影响实验结果.故填:不变.
点评:本题主要考查物质的性质、实验现象、计算等方面的知识,解答时要理解仪器的特点和各种物质的作用,并且能够结合数学知识进行正确地计算.

练习册系列答案
相关题目
 表示氯原子,
表示氯原子, 表示钠原子,
表示钠原子, 表示氧原子)
表示氧原子)
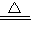 2Cu+H2O),则在水的组成测定中,所得氧元素的含量______(偏大、偏小、不变).
2Cu+H2O),则在水的组成测定中,所得氧元素的含量______(偏大、偏小、不变).