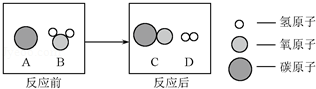
题目内容
【题目】图是某化肥的标签,请列式计算,以解决如下问题.
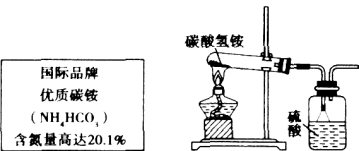
(1)通过计算碳酸氢铵的含氮量,说明此标签是否有错误.
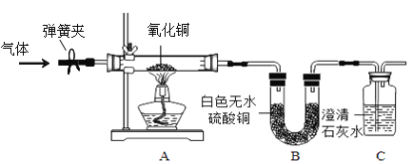
(2)根据国家标准,碳铵化肥中的NH4HCO3含量不得低于95%,陈红同学利用图所示的装置和如下反应进行了三次实验,且假设杂质不发生反应.
NH4HCO3![]() NH3↑+H2O+CO2↑
NH3↑+H2O+CO2↑
2NH3+H2SO4=(NH4)2SO4
实验结果如下:
实验次数 | 1 | 2 | 3 | 平均值 |
使用样品的质量/g | 8.00 | 8.00 | 8.00 | 8.00 |
硫酸增加的质量/g | 1.71 | 1.69 | 1.70 | 1.70 |
①陈红认为硫酸增加的质量是氨气(NH3)的质量,根据陈红的分析,请利用实验平均值计算出该化肥中碳酸氢铵的百分含量.
②这个结果能否说明这种化肥合格与否,请说明原因.
【答案】(1)碳酸氢铵的含氮量为
![]() ,因为纯净的碳酸氢铵的含氮量只能达到17.7%,不可能如标签所述含氮量高达20.1%,所以标签有错误.
,因为纯净的碳酸氢铵的含氮量只能达到17.7%,不可能如标签所述含氮量高达20.1%,所以标签有错误.
(2)①按陈红同学的分析,设8g样品化肥中含碳酸氢铵的质量为x.
NH4HCO3![]() NH3↑+H2O+CO2↑
NH3↑+H2O+CO2↑
79 17
x 1.70g
![]() x=7.9g
x=7.9g
则化肥中碳酸氢铵的含量为![]() .
.
②这个结果不能说明此化肥是否符合国家标准,因为根据图所示装置,硫酸增加的质量除NH3的质量外,还有反应生成水蒸气的质量,实验设计本身有错误.
【解析】(2)①陈红认为硫酸增加的质量即为NH3的质量,由此计算NH4HCO3的质量,进而求出其百分含量.

练习册系列答案
相关题目