题目内容
【题目】某品牌化妆品中含有一种含钙的化合物添加剂,同学们对这种添加剂产生了兴趣,并对其成分进行了如下探究:
[查阅资料]①碳酸钙、过氧化钙、氯化钙在某些方面可用作添加剂。
②过氧化钙(CaO2)是一种白色粉末,微溶于水,易溶于稀盐酸,且发生反应得到过氧化氢和氯化钙。
[提出问题]化妆品中添加剂的成分是什么?
[进行猜想]猜想1.碳酸钙;猜想2.过氧化钙;猜想3.氯化钙。
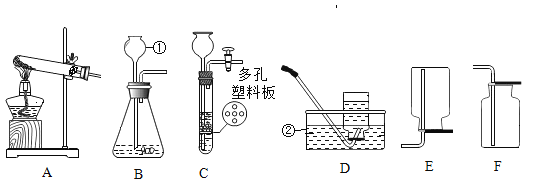
[实验探究]如图所示(试剂足量)的装置气密性良好,先通入氮气,再加热铜网至红热,然后缓慢滴人过量稀盐酸,通入氮气至冷却,观察现象。
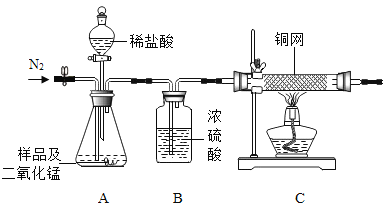
[实验现象]A中观察到的现象是有气泡产生,C中观察到的现象是_____。
[实验结论]猜想2正确。
[实验拓展]
(1)A中的MnO2在反应前后_____一定都不改变。
(2)样品完全反应后,继续缓慢通人N2的目的是_____。
(3)写出过氧化钙与稀盐酸反应的化学方程式:_____。
(4)实验测得C装置中铜网增重1.6g,样品中过氧化钙的质量为_____g。
【答案】红色固体变黑色 质量和化学性质 使反应生成的氧气全部和铜反应,同时防止空气中的氧气和铜反应 ![]() 7.2
7.2
【解析】
[实验现象] 过氧化钙(CaO2)是一种白色粉末,微溶于水,易溶于稀盐酸,且发生反应得到过氧化氢和氯化钙。过氧化氢在二氧化锰的作用下分解生成氧气,A中观察到的现象是有气泡产生,说明生成了氧气,氧气和铜在加热条件下生成氧化铜,C中观察到的现象是红色固体变黑色;
[实验拓展](1)能改变其他物质的反应速率,而本身的质量和化学性质在反应前后不变的物质叫催化剂。二氧化锰是过氧化氢分解的催化剂,A中的MnO2在反应前后质量和化学性质一定都不改变;
(2)样品完全反应后,继续缓慢通人N2的目的是使反应生成的氧气全部和铜反应,同时防止空气中的氧气和铜反应;
(3)过氧化钙(CaO2)是一种白色粉末,微溶于水,易溶于稀盐酸,且发生反应得到过氧化氢和氯化钙,化学方程式: ![]() ;
;
(4)实验测得C装置中铜网增重1.6g,即参与反应的氧气的质量为1.6g,设样品中过氧化钙的质量为x;由方程式![]() 、2H2O2
、2H2O2![]() 2H2O+O2↑ 可知:CaO2~ H2O2~
2H2O+O2↑ 可知:CaO2~ H2O2~![]() O2
O2
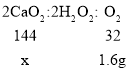
![]()
x=7.2g

 阅读快车系列答案
阅读快车系列答案