题目内容
【题目】某化学兴趣小组的同学参照教科书内容,在学校实验室里完成了以下两个实验:
实验一:配制溶质质量分数为6%的NaCl溶液50 g,按如下步骤进行操作:
![]()
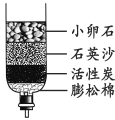
实验二:称取5.0 g粗盐进行提纯。粗盐除含有NaCl外,还含有MgCl2、CaCl2以及泥沙等杂质。为了有效将粗盐提纯,实验的各步操作流程如下图所示:

请你根据以上信息回答下述问题:
(1)配制50 g溶质质量分数为6%的NaCl溶液,需NaCl______g,水______mL。
(2)NaCl溶解过程中用到了玻璃棒,它的作用是________________。
(3)粗盐提纯时,操作Ⅰ的名称为__________________。
(4)某同学所得精盐比其他同学明显要少,原因可能是____________________。
A.溶解时将5.0 g粗盐一次全部倒入水中,立即过滤
B.蒸发时有一些液体、固体溅出
C.提纯后所得精盐尚未完全干燥
【答案】(1)3 47 (2)搅拌,加速溶解 (3)过滤 (4)AB
【解析】(1)氯化钠:50 g×6%=3 g,需要水:50 g-3 g=47 g,体积:![]() =47 mL;(2)NaCl溶解过程中用到了玻璃棒,是为了搅拌加速氯化钠溶解的;(3)泥沙不溶于水,将不溶于液体的固体与液体分离的方法是过滤;(4)溶解时将5.0 g粗盐一次全部倒入水中,立即过滤,有没溶解的氯化钠被过滤掉,所以所得精盐减少;蒸发时有一些液体、固体溅出,会导致氯化钠减少,所得精盐比其他同学明显要少;提纯后所得精盐尚未完全干燥,只能导致质量增多。
=47 mL;(2)NaCl溶解过程中用到了玻璃棒,是为了搅拌加速氯化钠溶解的;(3)泥沙不溶于水,将不溶于液体的固体与液体分离的方法是过滤;(4)溶解时将5.0 g粗盐一次全部倒入水中,立即过滤,有没溶解的氯化钠被过滤掉,所以所得精盐减少;蒸发时有一些液体、固体溅出,会导致氯化钠减少,所得精盐比其他同学明显要少;提纯后所得精盐尚未完全干燥,只能导致质量增多。
方法归纳 过滤应注意的事项:一贴:滤纸紧贴漏斗内壁。二低:滤纸边缘低于漏斗边缘;液面稍低于滤纸边缘。三靠:烧杯嘴靠近玻璃棒;玻璃棒靠近滤纸三层处;漏斗下端尖口靠近烧杯内壁。
蒸发应注意的事项:蒸发的同时用玻璃棒不断搅拌(使液体受热均匀,防止液滴飞溅);加热至较多量晶体析出,即可停止加热(利用余热使水分蒸发)。