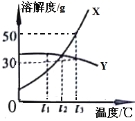
题目内容
逻辑推理是一种重要的化学思维方法.以下推理合理的是
A. 酸中一定含有氢元素,所以含有氢元素的物质一定是酸
B. 中和反应生成盐和水,所以生成盐和水的反应一定是中和反应
C. 某物质在氧气中燃烧后生产二氧化碳和水,所以该物质中一定含有碳、氢元素
D. 碱溶液都能使无色酚酞溶液变红,所以能使无色酚酞溶液变红的一定是碱溶液
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科学城中学的另一化学兴趣小组用石灰石(含杂质SiO2、CaO,还可能含有少量的Fe2O3)与足量的稀盐酸制备二氧化碳气体,实验结束后对废液中的溶质成分还进行了探究(溶解于水中的气体成分忽略不计)。
(提出问题)废液中的溶质含有哪些物质?
(查阅资料)
①SiO2不溶于水,且不与稀盐酸反应。
②FeCl3溶液遇到硫氰化钾(KSCN)溶液能够很灵敏的显现出红色。
③FeCl3只能在较强的酸性溶液中存在,若pH>3.8时,FeCl3会完全与水发生反应生成Fe(OH)3沉淀。
④已知反应:CaCl2+Na2CO3===CaCO3↓+2NaCl。
(假设猜想)
该小组同学一致认为废液中除含有CaCl2外,还作出以下三种合理的猜想。
猜想1:溶质只有CaCl2
猜想2:溶质有CaCl2和HCl
猜想3:溶质有CaCl2,HCl和FeCl3
请写出猜想3中有FeCl3的依据_______(用化学方程式表示)。
(实验验证)
实验操作 | 实验现象 | 实验结论 |
步骤1:取少量过滤后的废液于试管中, 滴加溶液__________。 | 溶液没有变红 | 废液的溶质中不含FeCl3 |
步骤2:另取少量过滤后的废液于试管中, 加入过量的Na2CO3溶液。 | ____________________ | 猜想2成立 |
(反思评价)
(1)上述步骤2中,小明同学提出可以通过检测废液的pH来判断是否含有HCl。你认为该方案是否合理,其原因是_______。
(2)根据实验结论,实验结束后若要回收CaCl2溶液,正确的操作是:向废液中加入过量的_______,过滤。




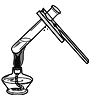 加热液体 B. 倾
加热液体 B. 倾 倒液体
倒液体 稀释浓硫酸 D.
稀释浓硫酸 D.  检查气密性
检查气密性