题目内容
将一定量的Na2O2固体投入到一定量的CuSO4溶液中,生成蓝色沉淀,同时产生一种能使带火星木条复燃的气体。
(1)写出该反应化学方程式_____________________(其中Na2O2与CuSO4的化学计量数之比为1:1)。
(2)因为该实验是放热反应,某同学观察到部分蓝色沉淀转变成黑色的固体。蓝色沉淀受热分解的化学方程式是______________________。
练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
物质性质决定用途。下列说法不正确的是
A.氧气具有助燃性,可用于炼钢
B.氩气的化学性质稳定,可用作焊接金属的保护气
C.铁的活泼性比铝弱,铁制品比铝制品在空气中更耐腐蚀
D.钨的熔点高,可用于制造白炽灯灯丝
水是人类必不可少的宝贵资源。请回答问题:
(1)
水资源紧缺程度 | 轻度缺水 | 中度缺水 | 重度缺水 | 极度缺水 |
人均水量(m3 • a_1)a为年的符号 | 1700-3000 | 1000-1700 | 500-1000 | <500 |
我国的人均水量约为2300m3 • a-1,居世界80几位,水资源紧缺程度为_____。水是生命之源,我们每个人都要爱护水资源。一方面要_____,另一方面要防治水体污染。
(2)自然界中的水都不是纯水,利用沉淀、_____ 、吸附和蒸馏等方法可以净化水。生活中可以用_____简便快捷的区分硬水和软水。随着科学技术的进步,新型净水剂高铁酸钠(Na2FeO4)取代了传统净水剂,高铁酸钠中铁元素的化合价是_____。
(3)做电解水实验时,观察到两个电极上有气泡冒出,一段时间后正极与负极产生的气体体积比约为_____。法国化学家拉瓦锡通过对水的生成和分解实验的研究,确认水是由_____和_____组成的。


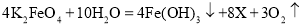 。 x的化学式为_____________________;
。 x的化学式为_____________________;
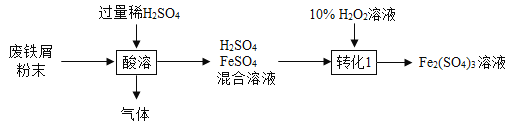

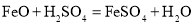
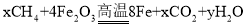 。下列说法正确的是_____________________;(选填序号)。
。下列说法正确的是_____________________;(选填序号)。
 量筒读数 B.
量筒读数 B.  倾倒液体
倾倒液体 点燃酒精灯 D.
点燃酒精灯 D.  滴加稀盐酸
滴加稀盐酸