题目内容
【题目】【2016年青海省西宁市】某化学兴趣小组在探究稀盐酸的化学性质时,做了如图一所示的三个实验。
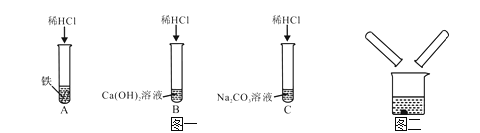
(1)A试管中的反应现象是 。
(2)C试管中反应的化学方程式是 。
(3)实验结束后,小组同学将B、C两支试管中的废液同时倒入一个洁净的烧杯中(如图二所示),观察到先有气泡产生,后有白色沉淀生成。同学们将烧杯内的物质进行过滤,对所得滤液的溶质成分进行探究。
【提出猜想】
甲同学猜想:有NaCl
乙同学猜想:有NaCl、CaCl2 丙同学猜想:有NaCl、CaCl2、 HCl
你的猜想: 有 。
【交流讨论】
你认为 同学的猜想一定不正确,理由是 。
【设计实验】请设计实验证明你的猜想正确。
实验步骤 | 实验现象 | 实验结论 |
取少量滤液于试管中,向其中滴加 。 | _________________。 | 我的猜想成立 |
【反思与总结】判断反应后溶液中溶质的成分,除要考虑生成物外,还需考虑 。
【答案】(1)铁片表面有气泡产生,溶液由无色逐渐变为浅绿色
(2)Na2CO3 + 2HCl===2NaCl + H2O + CO2↑
(3)你的猜想:NaCl、Na2CO3 丙 理由是:白色沉淀是CaCO3,能与盐酸反应,二者不能共存(表述合理即可)
实验步骤 | 实验现象 | 实验结论 |
取少量滤液于试管中,向其中滴加 无色酚酞试液 。 | 溶液变红 | 我的猜想成立 |
(或滴加紫色石蕊试液,实验现象为紫色石蕊试液变蓝;滴加稀盐酸等稀酸,实验现象为产生气泡;滴加CaCl2溶液、BaCl2溶液、Ca(NO3)2溶液、Ba(NO3)2溶液、Ca(OH)2溶液、Ba(OH)2溶液,实验现象为产生白色沉淀等合理即可,但要注意所加试剂与实验现象相对应。)反应物是否有剩余 (表述合理即可)
【解析】根据金属活动性顺序可知(1)A中的现象为铁片表面有气泡产生,溶液由无色逐渐变为浅绿色;
(2)C试管中反应的化学方程式是Na2CO3 + 2HCl===2NaCl + H2O + CO2↑;
(3)有实验现象可知,B盐酸剩余,C为碳酸钠剩余;二者混合后,一定没有盐酸,根据反应程度,故猜想为NaCl、Na2CO3
【交流讨论】白色沉淀是CaCO3,能与盐酸反应,二者不能共存,故丙同学的不正确;
【设计实验】根据结论可知含有氯化钠和碳酸钠,根据碳酸钠的性质进行操作取少量滤液于试管中,向其中滴加 无色酚酞试液,溶液变红色即可证明。