题目内容
(2012?盘锦)取一定量的氯化钠与氢氧化钠的混合物,加一定量的水配制成100g溶液,然后向其中滴加氯化镁溶液,直至恰好完全反应,共消耗氯化镁溶液45.8g.过滤,得到一定量的沉淀和140g质量分数为10%的氯化钠溶液.
(1)求生成沉淀的质量.
(2)求原混合物中氢氧化钠的质量分数.(结果保留到0.1%)
(1)求生成沉淀的质量.
(2)求原混合物中氢氧化钠的质量分数.(结果保留到0.1%)
分析:(1)根据沉淀的质量为混合物的水溶液质量与消耗的氯化镁的质量和减去最后得到的氯化钠溶液的质量进行解答.
(2)原混合物中氢氧化钠的质量分数=
,首先根据沉淀的质量求出氢氧化钠的质量,和生成的氯化钠的质量,然后根据最后得到的140g氯化钠溶液是原混合物中的氯化钠和生成的氯化钠溶于水所形成,故可求出原混合物中氯化钠的质量,进而求出了混合物的质量,然后代入公式进行计算即可.
(2)原混合物中氢氧化钠的质量分数=
| 氢氧化钠的质量 |
| 原混合物的质量 |
解答:解:(1)沉淀的质量为反应前溶液的质量减去反应后溶液的质量,即沉淀的质量为混合物的水溶液质量与消耗的氯化镁的质量和减去最后得到的氯化钠溶液的质量:
100g+45.8g-140g=5.8g.
答:生成沉淀的质量是5.8g.
(2)设原混合物中氢氧化钠的质量为x,生成氯化钠的质量为y
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
80 58 117
x 5.8g y
=
=
x=8g,y=11.7g
则原混合物中氯化钠的质量为:140×10%-11.7g=2.3g
故原混合物中氢氧化钠的质量分数为:
×100%=77.7%
答:原混合物中氢氧化钠的质量分数为77.7%.
100g+45.8g-140g=5.8g.
答:生成沉淀的质量是5.8g.
(2)设原混合物中氢氧化钠的质量为x,生成氯化钠的质量为y
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
80 58 117
x 5.8g y
| 80 |
| x |
| 58 |
| 5.8g |
| 117 |
| y |
x=8g,y=11.7g
则原混合物中氯化钠的质量为:140×10%-11.7g=2.3g
故原混合物中氢氧化钠的质量分数为:
| 8g |
| 8g+2.3g |
答:原混合物中氢氧化钠的质量分数为77.7%.
点评:本题入手点时求出沉淀的质量,关键是会求原混合物的质量,需要同学们严密的逻辑思维能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
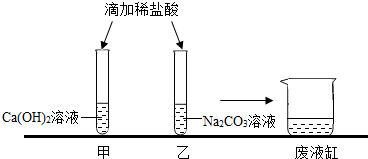 (2012?盘锦)甲乙两位同学在学完酸碱盐的化学性质之后,分别作了如下的实验
(2012?盘锦)甲乙两位同学在学完酸碱盐的化学性质之后,分别作了如下的实验