��Ŀ����
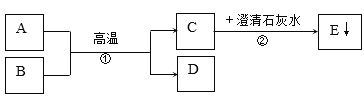
����Ŀ�������������ᳫ����̼������������ЧӦ�������DZ����ע�����⡣��ѧ������ �о���ͼ��ʾ�Ķ�����̼�µ�ѭ����ϵ��
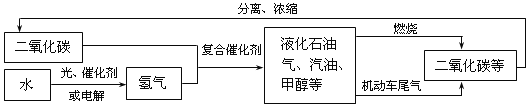
(1)��ͼ�з����ó������н����У��������___(����ĸ)��
A ������̼Ҳ��һ����Ҫ����Դ
B ���ý��¡���ѹ��������̼�����ǻ�ѧ�仯
C ������̼�������ڸ��ϴ����·�Ӧ�����ǻ����
D Һ��ʯ���������͡��״�������ȼ�ն��ж�����̼����
(2)�״���ѧʽ�� CH3OH���״���̼���⡢��Ԫ�ص�������Ϊ��___�� �״����ȼ�����ɶ�����̼��ˮ��д���״����ȼ�յĻ�ѧ����ʽ��___��
(3)����ɫ��ѧ�����ص�֮һ�������ŷ�����һ�������£�һ����̼�����������ղ�ͬ���� ��Ӧ����ֻ����һ�ֲ������ʵ�������ŷ�����������һҪ��IJ�����___(����ĸ)��
A �״�(CH4O) B �Ҵ�(C2H6O) C ��ȩ(C2H4O) D ��ȩ(CH2O)
(4)�������п���ѭ�����õ�������___��
���𰸡�B 3�U1�U4 2CH3OH+3O2![]() 2CO2+4H2O AD CO2
2CO2+4H2O AD CO2
��������
��1����ͼ�з����ó������н����У�
A��������̼��������ԭ�����ɼ״������͵ȣ�������̼��һ����Ҫ����Դ���ʸý�����ȷ�����������⣻
B�����ý��¡���ѹ��������̼�����������仯��ֻ�ǰѶ�����̼���������ʷֿ����ʸý��۴��������⣻
C��������̼�������ڸ��ϴ����·�Ӧ������Һ��ʯ���������͡��״��ȣ������ǻ����ʸý�����ȷ������������
D��Һ��ʯ���������͡��״��������ж�����̼Ԫ�أ���������Ӧ���ж�����̼�������ʸý�����ȷ�����������⣻
��ѡB��
��2���״���ѧʽ�� CH3OH���״���̼���⡢��Ԫ�ص�������=��12��1������1��4������16��1��=12:4:16=3:1:4���״����ȼ�յĻ�ѧ����ʽ��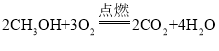 ��
��
���3:1:4 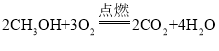 ��
��
��3������ɫ��ѧ�����ص�֮һ�ǡ����ŷš�������һ����̼��ѧʽ��֪��̼ԭ�Ӻ���ԭ�Ӹ�������1:1��������̼ԭ�Ӻ���ԭ�Ӹ�����Ҳ��1:1.һ�������£�һ����̼�����������ղ�ͬ������Ӧ����ֻ����һ�ֲ������ʵ�֡����ŷš���һ��һ����̼������һ������ӷ�Ӧ�õ�CH2O��һ��һ����̼�������������ӷ�Ӧ�õ�CH4O������һ����̼������һ������ӷ�Ӧ�õ�C2H2O2������һ����̼�������������ӷ�Ӧ�õ�C2H4O2����������ѡ����������Ӧ���ɵ�ֻ�У�AD��
��ѡ��AD
��4������������У�������̼����ѭ�����ã�
���������̼��

 ��ְٷְټ���ϵ�д�
��ְٷְټ���ϵ�д� �����ƻ���ĩ��̶�100��ϵ�д�
�����ƻ���ĩ��̶�100��ϵ�д� �ܿ���ȫ��100��ϵ�д�
�ܿ���ȫ��100��ϵ�д�