题目内容
100m L Na2CO3溶液中含溶质A g,若加入含CaCl2的质量分数为10%的溶液B g,则溶液恰好显中性.求:
(1)A与B的比值________.
(2)若改用其他试剂,为使反应后的溶液也恰好显中性,则应从溶质的质量分数均为10%的氢氧化钡溶液或盐酸中选用________试剂?它的质量是Bg的________倍.
解:(1)根据题意得,
CaCl2+Na2CO3═CaCO3↓+2NaCl
111 106
Bg×10% Ag
∴111:106=(Bg×10%):Ag,
则A:B=53:555;
(2)由于碳酸钠溶液呈碱性,所以选择盐酸来中和.
设盐酸的质量为X,
Na2CO3+2HCl=2NaCl+H2O
106 73
Ag 10%X
所以 ,
,
得到:X= ,
,
根据A:B=53:555 得到 B= ,
,
所以 ≈0.66.
≈0.66.
故答案为:(1)A:B=53:555;(2)稀盐酸,0.66.
分析:(1)根据已知条件和氯化钙与碳酸钠反应的化学方程式可以得出A与B的比例式,进而计算出A与B的比值;
(2)①由于碳酸钠溶液呈碱性,根据酸碱中和的性质,应选用酸性溶液稀盐酸;
②根据碳酸钠与稀盐酸反应的化学方程式得出盐酸的质量与Ag之间关系的比例式,再根据(1)中得出的A与B之间关系的比值,然后等量代换,即可求出稀盐酸质量是Bg的倍数.
点评:本题主要考查学生运用化学方程式解答问题的能力.学生需认真分析已知条件,运用等量代换,才能正确解答.
CaCl2+Na2CO3═CaCO3↓+2NaCl
111 106
Bg×10% Ag
∴111:106=(Bg×10%):Ag,
则A:B=53:555;
(2)由于碳酸钠溶液呈碱性,所以选择盐酸来中和.
设盐酸的质量为X,
Na2CO3+2HCl=2NaCl+H2O
106 73
Ag 10%X
所以
 ,
,得到:X=
 ,
,根据A:B=53:555 得到 B=
 ,
,所以
 ≈0.66.
≈0.66.故答案为:(1)A:B=53:555;(2)稀盐酸,0.66.
分析:(1)根据已知条件和氯化钙与碳酸钠反应的化学方程式可以得出A与B的比例式,进而计算出A与B的比值;
(2)①由于碳酸钠溶液呈碱性,根据酸碱中和的性质,应选用酸性溶液稀盐酸;
②根据碳酸钠与稀盐酸反应的化学方程式得出盐酸的质量与Ag之间关系的比例式,再根据(1)中得出的A与B之间关系的比值,然后等量代换,即可求出稀盐酸质量是Bg的倍数.
点评:本题主要考查学生运用化学方程式解答问题的能力.学生需认真分析已知条件,运用等量代换,才能正确解答.

练习册系列答案
相关题目
玉米是营养丰富的粗粮,玉米粉中的主要成分见表.
| 成分 | 蛋白质 | 糖类 | 水和维生素B等 | 钙 |
| 质量分数% | 约10 | 约80 | 约5 | 约0.23 |
缺钙能给人造成的影响是________(填写一条).
2加工玉米可得到淀粉,淀粉属于________(填序号,下同).
A.无机物 B.糖类 C.有机合成材料
(3)下列物质属于最清洁的燃料是________.
A.汽油 B.用淀粉制出的乙醇 C.煤 D.氢气
(4)被淋湿的玉米秸秆不易被点燃的主要原因是________.
 CaO+CO2
CaO+CO2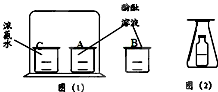 以下是小瑛和小方设计的有关分子性质的实验:小方的实验如图(1)所示.小瑛的实验如图(2)所示,锥形瓶中的小瓶里装着浓氨水,瓶口用一张刚刚用酚酞溶液浸过的滤纸盖住.
以下是小瑛和小方设计的有关分子性质的实验:小方的实验如图(1)所示.小瑛的实验如图(2)所示,锥形瓶中的小瓶里装着浓氨水,瓶口用一张刚刚用酚酞溶液浸过的滤纸盖住. .请你参与探究:
.请你参与探究:
 2CO2+3H2O,若反应生成4.4g CO2,试计算理论上消耗乙醇的质量.
2CO2+3H2O,若反应生成4.4g CO2,试计算理论上消耗乙醇的质量.