题目内容
(7分)水和溶液在生产、生活中起着十分重要的作用。
(1)下图是电解水实验装置。在实验过程中,试管1产生的气体是 ,写出水在通电条件下反应的化学方程式 。

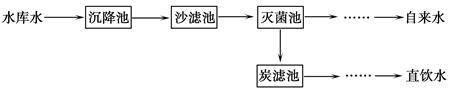
(2)将源水处理成自来水的过程中需加入生石灰,生石灰与水反应的化学方程式为__ __。
(3)20℃时,氯化钠的溶解度为36g,则20℃时氯化钠饱和溶液中溶质和溶剂的质量比为 。
(4)为了进行农业选种,现将200g30%的氯化钠溶液稀释为10%的氯化钠溶液,需要加水的质量为 。
(5)自来水中通入少量氯气可以杀菌消毒,化工厂常用浓氨水检测氯气储存设备或者输气管是否有氯气泄漏。A、B、C、D表示4种物质,其微观示意图见下表,A和B在一定条件下反应生成C和D。
D的化学式为 。
若17 g A参加反应,则生成C的质量为 g。
(1)下图是电解水实验装置。在实验过程中,试管1产生的气体是 ,写出水在通电条件下反应的化学方程式 。

(2)将源水处理成自来水的过程中需加入生石灰,生石灰与水反应的化学方程式为__ __。
(3)20℃时,氯化钠的溶解度为36g,则20℃时氯化钠饱和溶液中溶质和溶剂的质量比为 。
(4)为了进行农业选种,现将200g30%的氯化钠溶液稀释为10%的氯化钠溶液,需要加水的质量为 。
(5)自来水中通入少量氯气可以杀菌消毒,化工厂常用浓氨水检测氯气储存设备或者输气管是否有氯气泄漏。A、B、C、D表示4种物质,其微观示意图见下表,A和B在一定条件下反应生成C和D。
| 物质 | A | B | C | D |  |
| 化学式 | NH3 | Cl2 | N2 | | |
| 微观示意图 |  |  |  |  |
若17 g A参加反应,则生成C的质量为 g。
(1)氢气 2H2O通电2H2↑+ O2↑ (2) CaO + H2O ="==" Ca(OH)2
(3)9:25 (4)400g (5)① HCl ②14
(3)9:25 (4)400g (5)① HCl ②14
试题分析:(1) 电解水实验口诀:正氧负氢,氢二氧一,即与电源正极相连产生的是氧气,与电源负极相连产生的是氢气,所以试管1产生的气体是氢气,反应的化学方程式:2H2O通电2H2↑+ O2↑
(2) 生石灰与水反应的化学方程式为:CaO + H2O ="==" Ca(OH)2
(3) 20℃时,氯化钠的溶解度为36g,意思是在20℃时,100g水中达到饱和状态最多溶解氯化钠的质量为36g,所以20℃时氯化钠饱和溶液中溶质和溶剂的质量比=36:100=9:25
(4)将200g30%的氯化钠溶液稀释为10%的氯化钠溶液,稀释过程中溶质的质量不变,可设需水的质量为x,列式为:200g×30%=(200g+x)×10%,x=400g
(5)①根据微观示意图,可D的化学式为HCl,②所以该反应的化学方程式:2NH3+3Cl2=N2[来+6 HCl,根据方程式中A和C的质量关系34:28,所以若17 g A参加反应,则生成C的质量为14g

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目