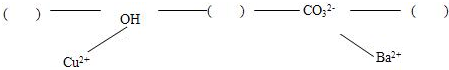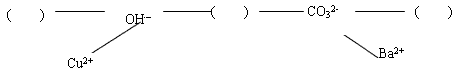题目内容
同学们在复习完酸碱盐的相关性质后又开展复分解反应研究性学习,进一步从
微观角度探究复分解反应的条件,设计了如下研究性学习思路:
【练习质疑】下列各组物质间均能反应,写出其反应的化学方程式.
①氢氧化钠溶液与硫酸混合
②碳酸钠溶液与硫酸混合
③硫酸铜溶液和氢氧化钠溶液混合
④氯化钡溶液与稀硫酸混合
【研究讨论】上述反应为什么能够发生?是因为这些反应物中含有特殊的阴、阳离子,
如①中有H+和OH-,②中有H+和CO32-,③中有
【构建网络】按照一定的顺序排列这些离子,就可以形成一种网络形式.在网络中,用短线相连的这些阴、阳离子能两两结合生成沉淀或气体或水.现有H+、Ca2+、NH4+,请将它们填入下面合适的“( )”中,使其形成一个更为完整的复分解反应网络
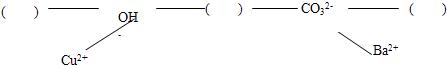
微观角度探究复分解反应的条件,设计了如下研究性学习思路:
【练习质疑】下列各组物质间均能反应,写出其反应的化学方程式.
①氢氧化钠溶液与硫酸混合
2NaOH+H2SO4=Na2SO4+2H2O
2NaOH+H2SO4=Na2SO4+2H2O
.②碳酸钠溶液与硫酸混合
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
.③硫酸铜溶液和氢氧化钠溶液混合
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
.④氯化钡溶液与稀硫酸混合
BaCl2+H2SO4=BaSO4↓+2HCl
BaCl2+H2SO4=BaSO4↓+2HCl
.【研究讨论】上述反应为什么能够发生?是因为这些反应物中含有特殊的阴、阳离子,
如①中有H+和OH-,②中有H+和CO32-,③中有
Cu2+和OH-
Cu2+和OH-
,④中有
Ba2+和SO42-
Ba2+和SO42-
.通过分析,硫酸在反应过程中的实质有所不同,在反应
①②
①②
(填序号)中是硫酸中H+所表现出来的性质;在反应
④
④
(填序号)中是硫酸根离子表现出来的性质.反应①的微观实质可用下图表示,请填上相关粒子的符号
【构建网络】按照一定的顺序排列这些离子,就可以形成一种网络形式.在网络中,用短线相连的这些阴、阳离子能两两结合生成沉淀或气体或水.现有H+、Ca2+、NH4+,请将它们填入下面合适的“( )”中,使其形成一个更为完整的复分解反应网络
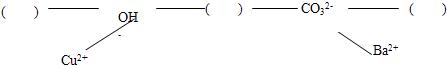
分析:[练习质疑]①氢氧化钠和硫酸发生中和反应生成硫酸钠和水;②碳酸钠与硫酸反应生成硫酸钠、水、放出二氧化碳;③硫酸铜和氢氧化钠反应生成氢氧化铜沉淀和硫酸钠;④氯化钡和硫酸反应生成硫酸钡沉淀和氯化钠;
[研究讨论]反应③中的铜离子与氢氧根离子形成氢氧化铜沉淀、反应④中的钡离子与硫酸离子形成硫酸钡沉淀,使反应满足有沉淀生成的复分解反应发生的条件;而反应①中氢离子与氢氧根离子形成水、反应②中氢离子与碳酸根离子形成水和气体二氧化碳,使反应满足有水或气体气体的复分解反应发生的条件,反应④则是由于硫酸根离子与钡离子形成沉淀而满足复分解反应发生的条件的;
[构建网络]利用离子间的反应关系:生成沉淀、气体或水即可发生反应,推断H+、Ca2+、NH4+三种离子在反应网络中的位置.
[研究讨论]反应③中的铜离子与氢氧根离子形成氢氧化铜沉淀、反应④中的钡离子与硫酸离子形成硫酸钡沉淀,使反应满足有沉淀生成的复分解反应发生的条件;而反应①中氢离子与氢氧根离子形成水、反应②中氢离子与碳酸根离子形成水和气体二氧化碳,使反应满足有水或气体气体的复分解反应发生的条件,反应④则是由于硫酸根离子与钡离子形成沉淀而满足复分解反应发生的条件的;
[构建网络]利用离子间的反应关系:生成沉淀、气体或水即可发生反应,推断H+、Ca2+、NH4+三种离子在反应网络中的位置.
解答:解:[练习质疑]①氢氧化钠溶液与硫酸混合,通过交换成分,生成硫酸钠和水;
故答案为:2NaOH+H2SO4=Na2SO4+2H2O;
②碳酸钠溶液与硫酸混合,通过交换成分生成硫酸钠和碳酸,碳酸易分解,生成物中的碳酸要写成水和二氧化碳;
故答案为:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑;
③硫酸铜溶液和氢氧化钠溶液混合,相互交换成分,生成氢氧化铜沉淀和硫酸钠;
故答案为:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4;
④氯化钡溶液与稀硫酸混合,相互交换成分,生成硫酸钡沉淀和氯化氢;
故答案为:BaCl2+H2SO4=BaSO4↓+2HCl;
[研究讨论]根据反应①②的分析,反应物中含有特殊的阴、阳离子即能形成水、气体或沉淀的两种离子;因此反应③中的特殊离子为Cu2+和OH-,形成氢氧化铜沉淀;反应④的特殊离子为Ba2+和SO42-,形成硫酸钡沉淀;
故答案为:Cu2+和OH-;Ba2+和SO42-;
硫酸在反应过程中的实质有所不同,反应①②中是由H+与OH-、CO32-离子形成水或气体二氧化碳;而反应④则是由于SO42-与Ba2+形成硫酸钡沉淀;
故答案为:①②;④;
[构建网络]根据“短线相连的这些阴、阳离子能两两结合生成沉淀或气体或水”的规律,在有H+、Ca2+、NH4+三种离子中既能与OH-又能与CO32-形成沉淀或气体或水的离子为H+,在有Ca2+、NH4+两种离子中NH4+能与OH-形成气体、而Ca2+能与CO32-形成沉淀;
故答案为:NH4+;H+;CO32-.
故答案为:2NaOH+H2SO4=Na2SO4+2H2O;
②碳酸钠溶液与硫酸混合,通过交换成分生成硫酸钠和碳酸,碳酸易分解,生成物中的碳酸要写成水和二氧化碳;
故答案为:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑;
③硫酸铜溶液和氢氧化钠溶液混合,相互交换成分,生成氢氧化铜沉淀和硫酸钠;
故答案为:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4;
④氯化钡溶液与稀硫酸混合,相互交换成分,生成硫酸钡沉淀和氯化氢;
故答案为:BaCl2+H2SO4=BaSO4↓+2HCl;
[研究讨论]根据反应①②的分析,反应物中含有特殊的阴、阳离子即能形成水、气体或沉淀的两种离子;因此反应③中的特殊离子为Cu2+和OH-,形成氢氧化铜沉淀;反应④的特殊离子为Ba2+和SO42-,形成硫酸钡沉淀;
故答案为:Cu2+和OH-;Ba2+和SO42-;
硫酸在反应过程中的实质有所不同,反应①②中是由H+与OH-、CO32-离子形成水或气体二氧化碳;而反应④则是由于SO42-与Ba2+形成硫酸钡沉淀;
故答案为:①②;④;
[构建网络]根据“短线相连的这些阴、阳离子能两两结合生成沉淀或气体或水”的规律,在有H+、Ca2+、NH4+三种离子中既能与OH-又能与CO32-形成沉淀或气体或水的离子为H+,在有Ca2+、NH4+两种离子中NH4+能与OH-形成气体、而Ca2+能与CO32-形成沉淀;
故答案为:NH4+;H+;CO32-.
点评:复分解反应的实质就是溶液中离子间的反应,溶液中离子间能形成沉淀或气体或水,复分解反应就能发生.

练习册系列答案
相关题目