题目内容
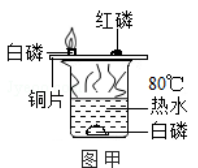
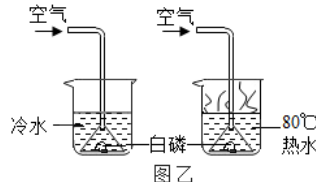
【题目】某同学要探究燃烧的条件和空气中氧气的含量,进行了如下实验. 【实验一】(已知:白磷的着火点为40℃)
实验装置 | 实验步骤及现象 |
| 步骤Ⅰ.检验装置的气密性,气密性良好. |
(1)对比步骤Ⅱ和Ⅳ的现象可知,可燃物燃烧的条件之一是
(2)待装置冷却一段时间后,打开K2 , 如果观察到 , 说明空气中氧气的体积约占 ![]() .若实验测得空气中氧气的体积分数小于
.若实验测得空气中氧气的体积分数小于 ![]() ,原因可能是(答一条即可).
,原因可能是(答一条即可).
(3)【实验二】用如图所示装置,利用铁生锈的原理也可以比较准确地测出空气中氧气的含量.若将此装置中的细铁丝换成足量的细铜丝进行实验,能否比较准确地测出空气中氧气的含量,并说明理由【已知:铜能与空气中氧气、水、二氧化碳反应生成铜绿.化学方程式:2Cu+O2+H2O+CO2═Cu(OH)2CO3】 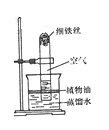
【答案】
(1)温度达到着火点
(2)水倒流进A瓶40mL;气密性不好、未等装置冷却就打开夹子等
(3)不能;因为空气中二氧化碳含量约只有0.03%,铜不能将装置中的氧气几乎耗尽
【解析】解:【实验一】(1)可燃物燃烧的条件是与氧气接触、达到着火点,步骤Ⅱ中的白磷与氧气接触,但温度没有达到白磷的着火点,步骤Ⅳ中的白磷与氧气接触,温度达到白磷的着火点,因此通过对比可得出可燃物燃烧的条件之一是温度达到可燃物的着火点;所以答案是:温度达到着火点;(2)步骤Ⅳ中装置A内的空气为200mL,因此要得出氧气约占空气体积的 ![]() ,因此消耗的氧气应该是200mL×
,因此消耗的氧气应该是200mL× ![]() =40mL,则观察到的现象是水倒流进A瓶40mL;影响实验结果偏小的因素可能是气密性不好、未等装置冷却就打开夹子等;所以答案是:水倒流进A瓶40mL;气密性不好、未等装置冷却就打开夹子等;
=40mL,则观察到的现象是水倒流进A瓶40mL;影响实验结果偏小的因素可能是气密性不好、未等装置冷却就打开夹子等;所以答案是:水倒流进A瓶40mL;气密性不好、未等装置冷却就打开夹子等;