题目内容
【题目】某集气瓶里盛有氮气和氧气的混合气体(体积比为4:1),采用燃烧法要除去氧气而得到较纯净的氮气,选用的试剂最好是( )
A.铝箔 B.红磷 C.木炭 D.硫黄
【答案】B
【解析】
试题分析:A、铝箔在氮气和氧气的混合气体中不能燃烧,不能除去氧气.故A错误;B、磷与氧气反应生成固体五氧化二磷,可以除去氧气,得到较为纯净的氮气.故B正确;C、木炭与氧气反应生成气体二氧化碳,虽除去氧气,而增加了新的气体.故C错误;D、硫与氧气反应生成气体二氧化硫,虽除去氧气,而增加了新的气体.故D错误。故选B。

 轻松夺冠全能掌控卷系列答案
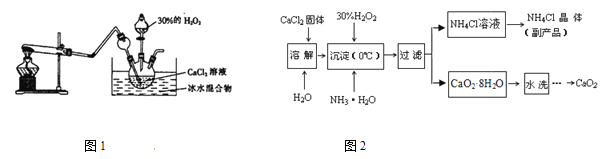
轻松夺冠全能掌控卷系列答案【题目】为比较相同浓度的FeCl3溶液和CuSO4溶液对H2O2分解的速率影响效果,某研究小组进行了如下探究:

【定性研究】
(1)如图甲,可通过观察_________________来定性比较两者的速率影响效果。
【定量研究】
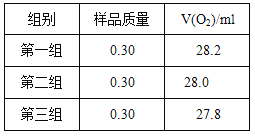
(2)如图乙,实验前检查该装置气密性的方法是__________________________。要定量比较两者的速率影响效果,可测量生成等体积气体所需的_______________。
【深入研究】
(3)在FeCl3溶液中,究竟是哪种粒子影响过氧化氢的分解速率?
猜想1:水分子(H2O)影响过氧化氢的分解速率;
猜想2:___________影响过氧化氢的分解速率;
猜想3:___________影响过氧化氢的分解速率;……
请设计实验,验证猜想
实验操作 | 实验现象 | 实验结论 |
分别取同温度同体积同浓度的H2O2溶液于2支试管中,再分别加入等质量的FeCl3和NaCl。观察现象。 | 加入FeCl3的试管中产生的气体快,加入NaCl的试管中产生的气体慢。 | 证明是Fe3+影响过氧化氢的分解速率 |
(4)【反思与讨论】上述实验确实可以证明Fe3+可以改变过氧化氢的分解速率,但不能证明FeCl3是过氧化氢分解的催化剂。若要证明FeCl3是过氧化氢分解的催化剂,还需要通过实验证明FeCl3在反应前后 ___________________ 。
请写出FeCl3催化H2O2分解的化学方程式___________________________________。