题目内容
【题目】防止金属腐蚀,特别是钢铁的锈蚀是世界科学研究和技术领域中的重大问题.铁生锈的条件为与 同时接触.铁锈成分复杂,主要成分为氧化铁(Fe2O3), 物质可加速铁的锈蚀.
用盐酸除去铁锈的化学方程式为 ,为了防止铁制品生锈,应采取的措施是
(写出一种).
【查阅资料】小明同学发现铁生锈是铁与空气中的物质发生的一系列复杂的化学反应,生成氢氧化亚铁[Fe(OH)2],后在在空气中被氧化为氢氧化铁[Fe(OH)3],Fe(OH)3不稳定,在日光照射下发生缓慢的分解反应生成氧化铁Fe2O3,铁锈的化学式可简单表示为Fe2O3·nH2O.
【提出问题】铁锈(Fe2O3·nH2O)中n的值等于多少呢?
【问题探究】小明发现实验室中有一保管不善的铁粉,大部分已经结块成红褐色,为了探究铁锈(Fe2O3·nH2O)的组成,称取27.0g这种铁粉样品,按如图所示装置进行实验.

(1)为了保证实验安全,实验开始时应先 ,防止 .
(2)A中的现象是 ,B中浓硫酸的作用是 ,D中碱石灰作用是 .
(3)请指出该装置中有一处明显不足 .
【数据处理】以下是加热时间和A中固体质量关系图像及B、C中质量不再变化时B中浓硫酸、C中碱石灰装置质量变化情况
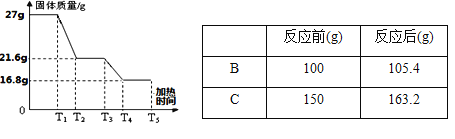
(1)n的值是 .
(2)写出T3-T4时间段发生反应的化学方程式 .
(3)计算原样品中单质铁的质量分数.
【答案】氧气和水,氯化钠或稀盐酸;Fe2O3+6HCl=2FeCl3+3H2O;保持表面清洁干燥.
(1)通CO,赶走空气;防止爆炸;
(2)红棕色变为黑色,吸收水蒸气,吸收CO2.
(3)尾气没有处理
【数据处理】(1)n值是3
(2)Fe2O3+3CO高温2Fe + 3CO2 ;
(3)铁的质量分数20.7%
【解析】
试题分析:铁生锈的条件为与氧气和水,同时接触.铁锈成分复杂,主要成分为氧化铁(Fe2O3), 化钠或稀盐酸;物质可加速铁的锈蚀.用盐酸除去铁锈的化学方程式为Fe2O3+6HCl=2FeCl3+3H2O,为了防止铁制品生锈,应采取的措施是保持表面清洁干燥.为了保证实验安全,实验开始时应先通CO,赶走空气;防止防止爆炸.A中的现象是红棕色变为黑色,B中浓硫酸的作用是吸收水蒸气,D中碱石灰作用是吸收CO2.该装置中有一处明显不足尾气没有处理,会造成空气的污染,T3-T4时间段发生反应的化学方程式Fe2O3+3CO高温2Fe + 3CO2;设生成氧化铁的质量是X,
Fe2O3+3CO高温2Fe + 3CO2
160 132
X 13.2克
列比例式得:160:X=132:13.2克 X=16克,水的质量是=105.4克-100克=5.4克,
16:160=5.4克:18n 解得n=3,所以含有铁锈的质量=16克+5.4克=21.4克,所以铁粉的质量=27克-21.4克=5.6克,原样品中单质铁的质量分数=5.6克/27克×100%=20.7%。

 阅读快车系列答案
阅读快车系列答案
