题目内容
【题目】氧化钙和碳酸钙的固体混合物质量为120g,将其高温煅烧至碳酸钙完全分解,称得剩余固体的质量为84g,则原固体混合物中钙元素的质量分数?
【答案】解法一
解:84gCaO含钙元素的质量=84g× ![]() ×100%=60g,反应前混合物中钙元素的质量也为60g,
×100%=60g,反应前混合物中钙元素的质量也为60g,
则原固体混合物中钙元素的质量分数= ![]() ×100%=50%
×100%=50%
答:原固体混合物中钙元素的质量分数为50%.
解法二
解:生成的二氧化碳的质量=120g﹣84g=36g
设原混合物中碳酸钙的质量为x
CaCO3 |
| CO2↑ |
100 | 44 | |
x | 36 |
100:44=x:36g 解之得 x≈81.8g
则原混合物中氧化钙的质量=120g﹣81.8g=38.2g
原混合物中钙元素的质量=81.8g× ![]() ×100%+38.2g×
×100%+38.2g× ![]() ×100%=60g
×100%=60g
则原固体混合物中钙元素的质量分数= ![]() ×100%=50%
×100%=50%
答:原固体混合物中钙元素的质量分数为50%.
【解析】方法一,因为反应后减少的是二氧化碳,钙元素全部转化为CaO中的钙,则只要计算出所有CaO中的钙元素即可求出;
方法二,利用生成的二氧化碳(120﹣84=36g)来计算参加反应的碳酸钙质量,同时也计算出混合物中氧化钙的质量,再分别计算这两种物质中含有钙元素的质量就能求出.
【考点精析】解答此题的关键在于理解根据化学反应方程式的计算的相关知识,掌握各物质间质量比=系数×相对分子质量之比.

 阅读快车系列答案
阅读快车系列答案【题目】某研究小组为探究“影响铁制品锈蚀快慢的因素”,取同浓度的稀氨水和稀醋酸用下面装置完成表中实验,回答下列问题. 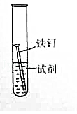
实验序号 | ① | ② | ③ | ④ |
实验温度/℃ | 25 | 25 | 70 | 70 |
试剂 | 稀氨水 | 稀醋酸 | 稀氨水 | 稀醋酸 |
出现铁锈所需时间 | 1天未见锈蚀 | 5分钟 | 1天未见锈蚀 | 1分钟 |
(1)铁锈的主要成分是(填化学式).
(2)实验②和④可探究因素对铁制品锈蚀快慢的影响,试探究试管酸碱性对铁制品锈蚀快慢的影响,应选择的实验是(填实验序号).
(3)根据表中实验现象得出的结论是(写出1点即可)
(4)影响铁制品锈蚀快慢除上述因素外,还有(写出1点即可),请设计实验方案 .