题目内容
(1)在水、铜和氯化钠3种物质中,由分子构成的化学式是______;(2)酒中含有乙醇(CH3CH2OH).乙醇由______种元素组成.
(3)A、B、C、D表示四种物质,其微观示意图见下表.A的蒸气和红热B在高温下反应生成C和D,写出反应的化学方程式______ CO+H2
【答案】分析:(1)根据金属和固态非金属单质等由原子构成,有些物质是由分子构成的,如水、气态非金属单质等,有些物质是由离子构成的,如氯化钠,进行分析判断即可.
(2)由乙醇(CH3CH2OH)化学式的含义进行分析解答.
(3)根据A、B、C、D四种微粒的构成确定它们的化学式,写出反应的化学方程式,由反应特征确定其反应类型即可.
解答:解:(1)水是由水分子构成的;铜属于金属单质,是由铜原子直接构成的;氯化钠是由钠离子和氯离子构成的.
(2)由乙醇(CH3CH2OH)的化学式可知,它是由碳、氢、氧三种元素组成的.
(3)1个A的分子由2个氢原子和1个氧原子构成,故其化学式为:H2O;同理B为C,C为CO,D为H2;根据题意,A的蒸气和红热B在高温下反应生成C和D,则反应的化学方程式为:H2O+C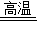 CO+H2;该反应是一种单质和一种化合物反应生成一种单质和一种化合物,属于置换反应.
CO+H2;该反应是一种单质和一种化合物反应生成一种单质和一种化合物,属于置换反应.
故答案为:(1)H2O;(2)3;(3)H2O+C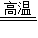 CO+H2;置换反应.
CO+H2;置换反应.
点评:本题难度不大,主要考查了构成物质的宏观组成与微观构成等知识,掌握常见物质的粒子构成、化学式的含义、从微观的角度分析物质的变化是正确解答本题的关键.
(2)由乙醇(CH3CH2OH)化学式的含义进行分析解答.
(3)根据A、B、C、D四种微粒的构成确定它们的化学式,写出反应的化学方程式,由反应特征确定其反应类型即可.
解答:解:(1)水是由水分子构成的;铜属于金属单质,是由铜原子直接构成的;氯化钠是由钠离子和氯离子构成的.
(2)由乙醇(CH3CH2OH)的化学式可知,它是由碳、氢、氧三种元素组成的.
(3)1个A的分子由2个氢原子和1个氧原子构成,故其化学式为:H2O;同理B为C,C为CO,D为H2;根据题意,A的蒸气和红热B在高温下反应生成C和D,则反应的化学方程式为:H2O+C
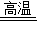 CO+H2;该反应是一种单质和一种化合物反应生成一种单质和一种化合物,属于置换反应.
CO+H2;该反应是一种单质和一种化合物反应生成一种单质和一种化合物,属于置换反应.故答案为:(1)H2O;(2)3;(3)H2O+C
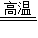 CO+H2;置换反应.
CO+H2;置换反应.点评:本题难度不大,主要考查了构成物质的宏观组成与微观构成等知识,掌握常见物质的粒子构成、化学式的含义、从微观的角度分析物质的变化是正确解答本题的关键.

练习册系列答案
相关题目
 (2004?厦门)下面是在鼓浪屿淑庄花园前新设的一组垃圾箱及说明:
(2004?厦门)下面是在鼓浪屿淑庄花园前新设的一组垃圾箱及说明: 有一种矿石称为“孔雀石”,它有孔雀羽毛般绿色斑纹,它的主要成分是碱式碳酸铜[Cu2(OH)2CO3].因碱式碳酸铜中含有铜元素,某兴趣小组同学对如何从孔雀石中提炼金属铜产生了浓厚兴趣,为此采集了适量的孔雀石样品,在老师的指导下进行了下列探究活动.
有一种矿石称为“孔雀石”,它有孔雀羽毛般绿色斑纹,它的主要成分是碱式碳酸铜[Cu2(OH)2CO3].因碱式碳酸铜中含有铜元素,某兴趣小组同学对如何从孔雀石中提炼金属铜产生了浓厚兴趣,为此采集了适量的孔雀石样品,在老师的指导下进行了下列探究活动.
