题目内容
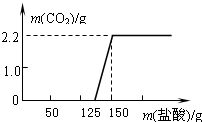 某研究性学习小组探究实验室中久置的NaOH的变质程度,先称取一定质量的NaOH样品(杂质为Na2CO3),配成溶液,然后向溶液中逐滴加入一定质量14.6%的稀盐酸,根据生成CO2的质量测定Na2CO3的质量,从而进一步确定样品中NaOH的变质程度.实验测得加入稀盐酸的质量与产生CO2气体的质量关系如图所示.
某研究性学习小组探究实验室中久置的NaOH的变质程度,先称取一定质量的NaOH样品(杂质为Na2CO3),配成溶液,然后向溶液中逐滴加入一定质量14.6%的稀盐酸,根据生成CO2的质量测定Na2CO3的质量,从而进一步确定样品中NaOH的变质程度.实验测得加入稀盐酸的质量与产生CO2气体的质量关系如图所示.Na---23 O---16 H---1 C---12 Cl---35.5
(1)根据图象可知,NaOH
(2)若全部变质,计算求出样品质量;若部分变质,求出其中一种物质质量.
分析:(1)根据图象可以看出,刚开始没有气体的生成,说明刚开始盐酸和氢氧化钠反应;从125克开始盐酸和碳酸钠反应.
(2)从图形可以看出,125克盐酸和氢氧化钠反应,(150-125)克盐酸和碳酸钠反应,然后写出化学方程式并代入数据计算即可.
(2)从图形可以看出,125克盐酸和氢氧化钠反应,(150-125)克盐酸和碳酸钠反应,然后写出化学方程式并代入数据计算即可.
解答:解:(1)从图象可以看出,刚开始没有气体的生成,说明刚开始盐酸和氢氧化钠反应;从125克开始盐酸和碳酸钠反应生成氯化钠和水和二氧化碳.所以氢氧化钠是部分变质,故答案为:部分.
(2)从图形可以看出,125克盐酸和氢氧化钠反应,则125克盐酸溶液中HCl的质量=125×14.6%═18.25克;(150-125)克盐酸和碳酸钠反应,则(150-125)克盐酸溶液中HCl的质量=(150-125)×14.6%═3.65克.设氢氧化钠的质量是X,碳酸钠的质量是Y.
NaOH+HCl═NaCl+H2O
40 36.5
X 18.25克
═
得:X=20克
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73
Y 3.65克
═
得:Y=5.3克
答:碳酸钠的质量是5.3克,氢氧化钠的质量是20克.
(2)从图形可以看出,125克盐酸和氢氧化钠反应,则125克盐酸溶液中HCl的质量=125×14.6%═18.25克;(150-125)克盐酸和碳酸钠反应,则(150-125)克盐酸溶液中HCl的质量=(150-125)×14.6%═3.65克.设氢氧化钠的质量是X,碳酸钠的质量是Y.
NaOH+HCl═NaCl+H2O
40 36.5
X 18.25克
| 40 |
| 36.5 |
| X |
| 18.25克 |
得:X=20克
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73
Y 3.65克
| 106 |
| 73 |
| Y |
| 36.5克 |
得:Y=5.3克
答:碳酸钠的质量是5.3克,氢氧化钠的质量是20克.
点评:学会分析图象并得出相应数据的方法,本题的关键是能够看出:125克盐酸和氢氧化钠反应,(150-125)克盐酸和碳酸钠反应.

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
 某研究性学习小组探究CuSO4溶液与NaOH溶液的反应产物.
某研究性学习小组探究CuSO4溶液与NaOH溶液的反应产物. 34、某研究性学习小组探究CuSO4溶液与NaOH溶液的反应产物.
34、某研究性学习小组探究CuSO4溶液与NaOH溶液的反应产物.