题目内容
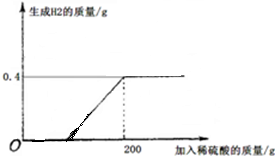 向20g黄铜(由锌、铜形成的合金)样品中加入稀硫酸充分反应,所加稀硫酸与生成气体的质量关系如图所示.求:
向20g黄铜(由锌、铜形成的合金)样品中加入稀硫酸充分反应,所加稀硫酸与生成气体的质量关系如图所示.求:(1)上述反应的化学方程式
(2)根据氢气的质量,列出求解锌质量(X)的
比例式
(3)样品中铜的质量分数
(4)若把10g黄铜样品加入200g稀硫酸充分反应后所得溶液的溶质是
考点:根据化学反应方程式的计算
专题:综合计算(图像型、表格型、情景型计算题)
分析:(1)根据锌和硫酸反应生成硫酸锌和氢气进行解答;
(2)根据图中数据可以判断生成氢气的质量;根据氢气的质量可以计算锌的质量;
(3)根据锌的质量进一步可以计算样品中铜的质量以及样品中铜的质量分数;
(4)根据加入200g稀硫酸时锌和硫酸恰好反应,所以反应后所得溶液是硫酸锌溶液进行解答.
(2)根据图中数据可以判断生成氢气的质量;根据氢气的质量可以计算锌的质量;
(3)根据锌的质量进一步可以计算样品中铜的质量以及样品中铜的质量分数;
(4)根据加入200g稀硫酸时锌和硫酸恰好反应,所以反应后所得溶液是硫酸锌溶液进行解答.
解答:解:(1)锌和硫酸反应生成硫酸锌和氢气,反应的化学方程式Zn+H2SO4═ZnSO4+H2↑;故填:Zn+H2SO4═ZnSO4+H2↑;
(2)设样品中锌的质量质量为X.
由图中可知,加入200g稀硫酸时,锌和硫酸恰好完全反应,生成氢气的质量是0.4g.
Zn+H2SO4═ZnSO4+H2↑
65 2
X 0.4g
=
X=13g
故填:
=
;
(3)样品中铜的质量分数为:
×100%=35%;故填:35%;
(4)加入200g稀硫酸时锌和硫酸恰好反应,所以反应后所得溶液是硫酸锌溶液,所以溶质是硫酸锌.故填:ZnSO4.
(2)设样品中锌的质量质量为X.
由图中可知,加入200g稀硫酸时,锌和硫酸恰好完全反应,生成氢气的质量是0.4g.
Zn+H2SO4═ZnSO4+H2↑
65 2
X 0.4g
| 65 |
| 2 |
| X |
| 0.4g |
X=13g
故填:
| 65 |
| 2 |
| X |
| 0.4g |
(3)样品中铜的质量分数为:
| 20g-13g |
| 20g |
(4)加入200g稀硫酸时锌和硫酸恰好反应,所以反应后所得溶液是硫酸锌溶液,所以溶质是硫酸锌.故填:ZnSO4.
点评:本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,比较简单,计算时要注意规范性和准确性.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案
相关题目
下列物质变化过程中,包含了化学变化的是( )
| A、石油制成布料 |
| B、铁丝编成铁网 |
| C、冰块制成冰雕 |
| D、木板制成桌椅 |
下列化肥中,属于钾肥的是( )
| A、硝酸钾 | B、氯化钾 |
| C、硝酸铵 | D、磷酸二氢铵 |