题目内容
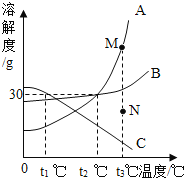
【题目】如图是甲、乙两物质的溶解度曲线图,下列说法不正确的是( )
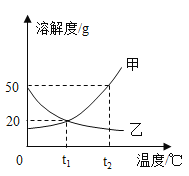
A.t2℃时,甲物质的溶解度大于乙物质的溶解度
B.将t2℃时甲物质的饱和溶液降温到t1℃,溶液仍然饱和
C.t1℃时,将l5g乙物质加入到50g水中,充分搅拌,能得到乙的饱和溶液
D.将t2℃时甲、乙两种物质的饱和溶液降温至t1℃,所得溶液中溶质质量分数大小为甲=乙
【答案】D
【解析】
根据固体的溶解度曲线,可以查出某物质在一定温度下的溶解度,从而确定形成物质的状态;可以比较不同物质在同一温度下的溶解度大小;可以判断物质的溶解度随温度变化的变化情况,从而判断温度改变后,溶液溶质质量分数的大小。
A、通过分析溶解度曲线可知,t2℃时,甲物质的溶解度大于乙物质的溶解度,故A正确;
B、甲物质的溶解度随温度的降低而减小,所以将t2℃时甲物质的饱和溶液降温到t1℃,有晶体析出,溶液仍然饱和,故B正确;
C、t1℃时,乙物质的溶解度是20g,50g的水中可以溶解乙固体10g,所以将l5g乙物质加入到50g水中,充分搅拌,能得到乙的饱和溶液,故C正确;
D、将t2℃时甲、乙两种物质的饱和溶液降温至t1℃,甲物质的溶解度减小,析出晶体,乙物质的溶解度增大,甲物质按照t1℃时的溶解度计算,乙物质按照t2℃时的溶解度计算,所以所得溶液中溶质质量分数大小为甲>乙,故D错误。
故选:D。

【题目】氧化镁在医药等行业应用广泛。实验室以菱镁矿(主要成分为MgCO3,含少量FeCO3,其他杂质不溶于水和酸)为原料制备高纯氧化镁的实验流程如下:
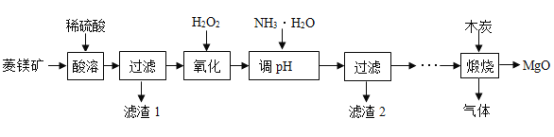
(1)为了提高“酸浸”的效果,可采取的措施有:适当升高温度、____________。MgCO3与稀硫酸反应的化学方程式为_________________。
(2)“氧化”过程中,将FeSO4全部转化为Fe2(SO4) 3,然后加氨水,调节溶液的PH范围为______________。(已知部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表)
对应离子 | Fe3+ | Fe2+ | Mg2+ |
开始沉淀时的pH | 2.7 | 7.9 | 9.4 |
完全沉淀时的pH | 3.7 | 9.6 | 11.4 |
(3)过滤后得到滤渣2和滤液,滤渣2是______(填化学式),此时滤液中的阳离子一定含有____________(填离子符号)。
(4)煅烧过程存在以下反应:![]() ;
;![]() ;
;![]()
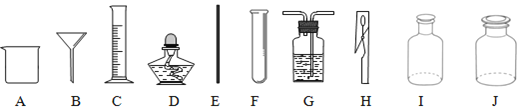
已知:①硫在常温下是一种淡黄色固体,硫的熔点约为115.2°C,沸点约为444.7°C;②高锰酸钾溶液与SO2反应会褪色,且只吸收SO2,不吸收CO2;③碱溶液既吸收SO2,又吸收CO2。利用下图装置对煅烧产生的气体进行检验并收集。
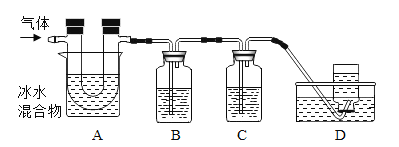
①集气瓶B中盛放的溶液是_______________(填字母),C中盛放的溶液是_____________(填字母)。
a Ca(OH)2溶液
b KMnO4溶液
c NaOH溶液
d BaCl2溶液
②装置D的作用是__________________________。
【题目】“学化学,爱化学,用好化学”学习小组的同学取氢氧化钠和碳酸钠的混合溶液50g装入烧杯中,每次滴加50g稀盐酸充分反应。测得部分数据及图像如下:
次数 | 1 | 2 | 3 | 4 | 5 |
加入稀盐酸质量/g | 50 | 50 | 50 | 50 | 50 |
烧杯中物质质量/g | 100 | 150 | 197.8 | 245.6 | 295.6 |
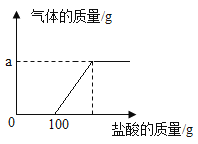
请根据有关信息计算:
(1)a的数值为_____。
(2)求原混合溶液中碳酸钠的质量分数。(写出计算过程)