题目内容
【题目】向53g质量分数为10%的碳酸钠溶液中逐滴加入质量分数为5%的稀盐酸,生成二氧化碳的质量随加入盐酸质量的变化关系如图所示.(不考虑CO2的溶解) 已知:
OB段反应的化学方程式为Na2CO3+HCl═NaCl+NaHCO3
BD段(不含B点)反应的化学方程式为NaH CO3+HCl═NaCl+H2O+CO2↑
请回答: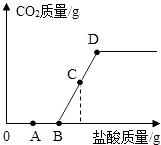
(1)53g质量分数为10%的碳酸钠溶液中溶质质量为g.
(2)A点对应溶液中溶质有(填化学式).
(3)B点横坐标为.(计算结果保留1位小数,下同)
(4)假设C点横坐标为54.75,计算C点对应的二氧化碳质量.(写出计算过程)
【答案】
(1)5.3
(2)Na2CO3、NaCl、NaHCO3
(3)36.5
(4)解:设C点对应的二氧化碳质量为y.
NaHCO3+ | HCl═NaCl+H2O+ | CO2↑ |
36.5 | 44 | |
(54.75g﹣36.5g)×5% | y |
![]() 解得:y=1.1g
解得:y=1.1g
【解析】解:(1)53g质量分数为10%的碳酸钠溶液中溶质质量为:53g×10%=5.3g.(2)由生成二氧化碳的质量随加入盐酸质量的变化关系可知,在如图A点时,溶液中碳酸钠部分与盐酸反应生成了氯化钠和碳酸氢钠,所以,对应溶液中溶质有:Na2CO3、NaCl、NaHCO3 . (3)由生成二氧化碳的质量随加入盐酸质量的变化关系可知,在如图B点时,溶液中碳酸钠恰好与盐酸反应生成了氯化钠和碳酸氢钠, 设与碳酸钠反应生成了氯化钠和碳酸氢钠的盐酸的质量为x
Na2CO3+ | HCl═NaCl+NaHCO3 |
106 | 36.5 |
5.3g | x×5% |
![]() 解得x=36.5g(4)设C点对应的二氧化碳质量为y.
解得x=36.5g(4)设C点对应的二氧化碳质量为y.
NaHCO3+ | HCl═NaCl+H2O+ | CO2↑ |
36.5 | 44 | |
(54.75g﹣36.5g)×5% | y |
![]() 解得:y=1.1g
解得:y=1.1g
故答为:(1)5.3;(2)Na2CO3、NaCl、NaH CO3;(3)36.5;(4)C点对应的二氧化碳质量未1.1g.
(1)根据溶质的质量分数计算;(2)根据生成二氧化碳的质量随加入盐酸质量的变化关系分析A点对应溶液中溶质;(3)根据在B点时Na2CO3与盐酸恰好反应生成了氯化钠和碳酸氢钠计算分析;(4)根据碳酸氢钠与盐酸反应的方程式及参加该反应盐酸的质量计算C点对应的二氧化碳质量.

 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案