题目内容
【题目】为了测定大理石中碳酸钙的质量分数(杂质不反应),甲学生设计了如下实验装置,用来收集产生的二氧化碳。
步骤:反应前称量B装置的质量;从分液漏斗中滴入足量的盐酸,当反应结束后,再次称量B装置的质量,增加的质量即为产生的CO2的质量。(资料:2NaOH +CO2= Na2CO3 + H2O,空气中的其他成分不与氢氧化钠反应)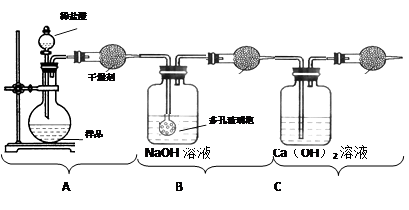
(1)B装置中多孔玻璃泡的作用是;C装置中石灰水的作用是。
(2)有同学提出质疑:此装置无法全部收集到生成的CO2 , 原因是。改进方法是。
(3)改进方法后进行实验,如果C装置中的现象是 , 只需利用B装置反应前后的质量来确定CO2的质量。
(4)实验前称取20g大理石和足量稀盐酸反应,改进方法后测得B装置质量增加了6.6g,求该大理石中碳酸钙的质量。(请写出计算过程)
【答案】
(1)增大接触面积,充分吸收CO2气体,检验CO2是否被完全吸收
(2)装置中残留CO2气体,结束后通N2;灌水
(3)不浑浊
(4)解:设大理石中碳酸钙的质量为x,则
CaCO3+ | 2HCl═ | CaCl2+H2O+ | CO2↑ |
100 | 44 | ||
x | 6.6g |
![]()
得x=15g
【解析】解:(1)B装置中多孔玻璃泡的作用是增大二氧化碳气体与氢氧化钠溶液的接触面积,充分吸收CO2气体;(2)通过装置C中石灰水不变浑浊,证明二氧化碳被氢氧化钠溶液吸收尽;有同学提出质疑:此装置无法全部收集到生成的CO2,原因是装置中残留CO2气体无法被吸收。改进方法是结束后向装置A中通N2或吸收尽二氧化碳后的空气;使装置中残留的二氧化碳被充分吸收。(3)改进方法后进行实验,如果C装置中的现象是不浑浊,说明生成的二氧化碳完全被吸收,只需利用B装置反应前后的质量来确定CO2的质量。
所以答案是:(1)增大接触面积,充分吸收CO2气体;检验CO2是否被完全吸收;(2)装置中残留CO2气体;结束后通N2;灌水;(3)不浑浊;(4)15g。
【考点精析】本题主要考查了根据化学反应方程式的计算的相关知识点,需要掌握各物质间质量比=系数×相对分子质量之比才能正确解答此题.

【题目】下列相关事实用微观粒子的知识解释正确的是( )
选项 | 事实 | 解释 |
A | 冰融化成水 | 分子间间隔变大 |
B | 金刚石与石墨性质差异较大 | 碳原子结构不同 |
C | 酸溶液使紫色石蕊溶液变红 | 酸溶液中都含有酸根离子 |
D | 一氧化碳可以做燃料 | 一氧化碳分子有可燃性 |
A.AB.BC.CD.D
