题目内容
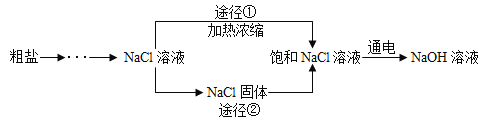
【题目】某同学设计的工业制备氢氧化钠的流程如图。
资料:①2NaCl + 2H2O![]() 2NaOH + H2↑+ Cl2↑,电极一端得到 NaOH 和 H2, 另一端得到Cl2。
2NaOH + H2↑+ Cl2↑,电极一端得到 NaOH 和 H2, 另一端得到Cl2。
②Cl2 用于生产 84 消毒液,其反应原理为:Cl2 + 2NaOH = NaCl + NaClO + H2O
(1)晾晒海水得到粗盐的原理是_________。
(2)实验室蒸发用到的仪器材料有铁架台、坩埚钳、石棉网、玻璃棒、酒精灯和______________。
(3)工业生产中应选择途径___________________获得饱和 NaCl 溶液。
(4)84 消毒液有效成分 NaClO 中氯元素的化合价为______________。
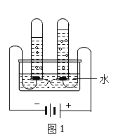
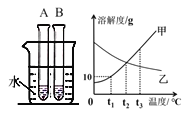
(5)图 1 实验探究水的组成,不能加入NaCl 增强水的导电性的理由是_____________;电解水的化学方程式___________________________________。
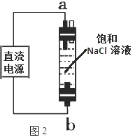
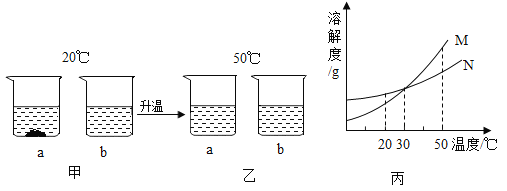
(6)图 2 实验获得 84 消毒液,直流电源正极应与______________ (填 a 或 b)连接, 才能使 NaClO 的含量更高。
【答案】蒸发结晶 蒸发皿 ① +1 加入 NaCl 后会有 Cl2 生成,会干扰实验探究结果 2H2O ![]() 2H2↑+O2↑ b
2H2↑+O2↑ b
【解析】
(1)晾晒海水得到粗盐的原理是蒸发结晶;
(2)实验室蒸发用到的仪器材料有铁架台、坩埚钳、石棉网、玻璃棒、酒精灯和蒸发皿;
(3)根据流程图可以看出,途径①的步骤简单,工业生产中应选择途径①;
(4)“84”消毒液的有效成分NaClO中,钠元素化合价是+1,氧元素化合价是-2,根据化合物中元素化合价代数和为零可知,氯元素的化合价为+1价;
(5)根据“2NaCl + 2H2O![]() 2NaOH + H2↑+ Cl2↑”可知,要测定水组成,不能加入NaCl增强水的导电性是因为加氯化钠会生成氯气,干扰实验结果,水通电时分解生成氢气和氧气,反应的化学方程式为:2H2O
2NaOH + H2↑+ Cl2↑”可知,要测定水组成,不能加入NaCl增强水的导电性是因为加氯化钠会生成氯气,干扰实验结果,水通电时分解生成氢气和氧气,反应的化学方程式为:2H2O ![]() 2H2↑+O2↑;
2H2↑+O2↑;
(6)电解食盐水时,负极一端得到 NaOH 和 H2, 正极一端得到Cl2,Cl2密度小于NaOH溶液的密度,生成的Cl2向上移动,能与氢氧化钠溶液充分接触,得到NaClO的含量更高。图3实验获得84消毒液,直流电源正极应与b连接,才能使 NaClO的含量更高。