题目内容
为了研究质量守恒定律,设计了如下实验,请分析有关问题: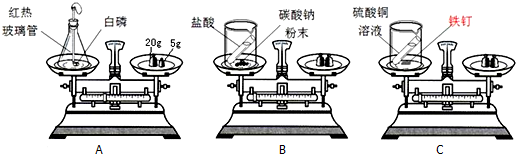
(1)装置A:锥形瓶的底部铺有一层细沙,其作用是
(2)A装置燃烧前称量,总质量为27.6g,则托盘天平中游码的读数为 g.
(3)B反应中发现托盘天平指针偏向右边,造成的原因是: 请写出装置B中的化学反应方程式:
(4)反思:实验B虽然天平会失去平衡但也是遵守质量守恒定律,理由是: 装置C中所发生的化学反应方程式是: .

(1)装置A:锥形瓶的底部铺有一层细沙,其作用是
(2)A装置燃烧前称量,总质量为27.6g,则托盘天平中游码的读数为
(3)B反应中发现托盘天平指针偏向右边,造成的原因是:
(4)反思:实验B虽然天平会失去平衡但也是遵守质量守恒定律,理由是:
考点:质量守恒定律及其应用,称量器-托盘天平,书写化学方程式、文字表达式、电离方程式
专题:化学用语和质量守恒定律
分析:(1)白磷燃烧生成的五氧化二磷温度很高,容易溅落,据此分析;
(2)考虑托盘天平读数为:砝码质量加游码的质量,据此分析;
(3)从B装置中有气体生成考虑;熟记稀盐酸与石灰石反应的化学反应式.
(4)在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变,据此分析;熟记铁与硫酸铜反应的化学反应式.
(2)考虑托盘天平读数为:砝码质量加游码的质量,据此分析;
(3)从B装置中有气体生成考虑;熟记稀盐酸与石灰石反应的化学反应式.
(4)在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变,据此分析;熟记铁与硫酸铜反应的化学反应式.
解答:解:
(1)锥形瓶应预先装少量的细砂的原因是防止磷燃烧生成的五氧化二磷溅落炸裂锥形瓶;
(2)燃烧前称量,锥形瓶的总质量为27.6g,则A图托盘天平中游码的读数为27.6g-(20+5)g=2.6g;
(3)B中稀盐酸与石灰石粉末反应有二氧化碳气体生成,二氧化碳散失到空气中,使剩余物质的质量比原物质质量减小.
稀盐酸与石灰石粉末反应式的化学式是:CaCO3+2HCl=CaCl2+H2O+CO2↑.
(4)在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变,所以实验B虽然天平会失去平衡但也是遵守质量守恒定律;铁与硫酸铜反应生成硫酸亚铁和单质铜,装置C中所发生的化学反应方程式是:Fe+CuSO4═FeSO4+Cu;
故答案为:
(1)防止锥形瓶底部局部受热爆裂;
(2)2.6;
(3)B中产生了CO2散失,使剩余物质的质量比原物质质量减小;
CaCO3+2HCl=CaCl2+H2O+CO2↑;
(4)在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变;Fe+CuSO4═FeSO4+Cu
(1)锥形瓶应预先装少量的细砂的原因是防止磷燃烧生成的五氧化二磷溅落炸裂锥形瓶;
(2)燃烧前称量,锥形瓶的总质量为27.6g,则A图托盘天平中游码的读数为27.6g-(20+5)g=2.6g;
(3)B中稀盐酸与石灰石粉末反应有二氧化碳气体生成,二氧化碳散失到空气中,使剩余物质的质量比原物质质量减小.
稀盐酸与石灰石粉末反应式的化学式是:CaCO3+2HCl=CaCl2+H2O+CO2↑.
(4)在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变,所以实验B虽然天平会失去平衡但也是遵守质量守恒定律;铁与硫酸铜反应生成硫酸亚铁和单质铜,装置C中所发生的化学反应方程式是:Fe+CuSO4═FeSO4+Cu;
故答案为:
(1)防止锥形瓶底部局部受热爆裂;
(2)2.6;
(3)B中产生了CO2散失,使剩余物质的质量比原物质质量减小;
CaCO3+2HCl=CaCl2+H2O+CO2↑;
(4)在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变;Fe+CuSO4═FeSO4+Cu
点评:在化学反应中遵循质量守恒定律,参加反应的物质的质量等于反应后生成的物质的质量.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
 某市售过氧乙酸(化学式为:C2H4O3)溶液,其标签上的部分文字说明如图.
某市售过氧乙酸(化学式为:C2H4O3)溶液,其标签上的部分文字说明如图.
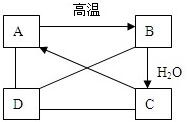 有A、B、C、D四种物质,如图所示:A、B、C在一定条件下可以发生转化,在C溶液中通入CO2,溶液变浑浊,生成白色沉淀A.D与A、B、C均能发生反应,D与C发生中和反应,D与A反应有CO2气体产生,D与AgNO3溶液反应,可产生不溶于稀硝酸的白色沉淀.
有A、B、C、D四种物质,如图所示:A、B、C在一定条件下可以发生转化,在C溶液中通入CO2,溶液变浑浊,生成白色沉淀A.D与A、B、C均能发生反应,D与C发生中和反应,D与A反应有CO2气体产生,D与AgNO3溶液反应,可产生不溶于稀硝酸的白色沉淀. 根据如图装置,回答下列问题:
根据如图装置,回答下列问题: