题目内容
 某小组同学用以下两种方法可以制得白色的Fe(OH)2沉淀.
某小组同学用以下两种方法可以制得白色的Fe(OH)2沉淀.已知:FeSO4+2NaOH═Fe(OH)2↓(白色)+Na2SO4
Fe(OH)2在空气中很容易被氧化.
方法一:FeSO4溶液与不含O2的NaOH溶液反应制备.
(1)除去蒸馏水中溶解的O2常采用
(2)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4液面下,再挤出NaOH溶液.这样操作的理由是
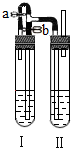
方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备.
(3)在试管Ⅰ里加入的试剂是
(4)在试管Ⅱ里加入的试剂是
(5)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是
(6)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是
考点:物质的相互转化和制备,气体溶解度的影响因素,盐的化学性质
专题:物质的制备
分析:(1)根据气体的溶解度随温度的升高而减小,进行分析解答.
(2)根据Fe(OH)2在空气中很容易被氧化,进行分析解答.
(3)根据铁屑与稀H2SO4反应生成硫酸亚铁溶液,硫酸亚铁溶液再与氢氧化钠溶液反应生成氢氧化亚铁沉淀,进行分析解答.
(4)根据铁屑与稀H2SO4反应生成硫酸亚铁溶液,硫酸亚铁溶液再与氢氧化钠溶液反应生成氢氧化亚铁沉淀,进行分析解答.
(5)Fe(OH)2在空气中很容易被氧化,为了制得白色Fe(OH)2沉淀,应在操作过程中隔绝氧气,据此进行分析解答.
(6)根据Ⅰ中产生的氢气将装置内的空气排出,反应过程中隔绝了氧气,进行分析解答.
(2)根据Fe(OH)2在空气中很容易被氧化,进行分析解答.
(3)根据铁屑与稀H2SO4反应生成硫酸亚铁溶液,硫酸亚铁溶液再与氢氧化钠溶液反应生成氢氧化亚铁沉淀,进行分析解答.
(4)根据铁屑与稀H2SO4反应生成硫酸亚铁溶液,硫酸亚铁溶液再与氢氧化钠溶液反应生成氢氧化亚铁沉淀,进行分析解答.
(5)Fe(OH)2在空气中很容易被氧化,为了制得白色Fe(OH)2沉淀,应在操作过程中隔绝氧气,据此进行分析解答.
(6)根据Ⅰ中产生的氢气将装置内的空气排出,反应过程中隔绝了氧气,进行分析解答.
解答:解:(1)氧气的溶解度随温度的升高而减小,除去蒸馏水中溶解的O2常采用煮沸的方法.
(2)由于Fe(OH)2在空气中很容易被氧化,生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4液面下,再挤出NaOH溶液,这样操作是为了隔绝氧气,防止氢氧化亚铁在空气中氧化.
(3)铁屑与稀H2SO4反应生成硫酸亚铁溶液,硫酸亚铁溶液再与氢氧化钠溶液反应生成氢氧化亚铁沉淀,故在试管Ⅰ里加入的试剂是铁屑与稀H2SO4.
(4)铁屑与稀H2SO4反应生成硫酸亚铁溶液,硫酸亚铁溶液再与氢氧化钠溶液反应生成氢氧化亚铁沉淀,故在试管Ⅱ里加入的试剂是氢氧化钠溶液.
(5)Fe(OH)2在空气中很容易被氧化,为了制得白色Fe(OH)2沉淀,应在操作过程中隔绝氧气,故在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是
待反应一段时间后,在Ⅱ处对氢气验纯(目的是验证是否还存在氧气),然后关闭a,打开b.
(6)这样生成的Fe(OH)2沉淀能较长时间保持白色,是因为Ⅰ中产生的氢气将装置内的空气排出,防止了氢氧化亚铁被空气氧化.
故答案为:(1)煮沸;(2)防止氢氧化亚铁在空气中氧化;(3)铁屑与稀H2SO4;(4)氢氧化钠溶液;(5)待反应一段时间后,在Ⅱ处对氢气验纯,然后关闭a,打开b;(6)Ⅰ中产生的氢气将装置内的空气排出,防止了氢氧化亚铁被空气氧化.
(2)由于Fe(OH)2在空气中很容易被氧化,生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4液面下,再挤出NaOH溶液,这样操作是为了隔绝氧气,防止氢氧化亚铁在空气中氧化.
(3)铁屑与稀H2SO4反应生成硫酸亚铁溶液,硫酸亚铁溶液再与氢氧化钠溶液反应生成氢氧化亚铁沉淀,故在试管Ⅰ里加入的试剂是铁屑与稀H2SO4.
(4)铁屑与稀H2SO4反应生成硫酸亚铁溶液,硫酸亚铁溶液再与氢氧化钠溶液反应生成氢氧化亚铁沉淀,故在试管Ⅱ里加入的试剂是氢氧化钠溶液.
(5)Fe(OH)2在空气中很容易被氧化,为了制得白色Fe(OH)2沉淀,应在操作过程中隔绝氧气,故在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是
待反应一段时间后,在Ⅱ处对氢气验纯(目的是验证是否还存在氧气),然后关闭a,打开b.
(6)这样生成的Fe(OH)2沉淀能较长时间保持白色,是因为Ⅰ中产生的氢气将装置内的空气排出,防止了氢氧化亚铁被空气氧化.
故答案为:(1)煮沸;(2)防止氢氧化亚铁在空气中氧化;(3)铁屑与稀H2SO4;(4)氢氧化钠溶液;(5)待反应一段时间后,在Ⅱ处对氢气验纯,然后关闭a,打开b;(6)Ⅰ中产生的氢气将装置内的空气排出,防止了氢氧化亚铁被空气氧化.
点评:本题难度不大,理解Fe(OH)2在空气中很容易被氧化、制得白色的Fe(OH)2沉淀的关键是反应过程中要隔绝氧气是正确解答本题的关键.

练习册系列答案
相关题目
生活中的下列现象属于化学变化的是( )
| A、钢铁生锈 | B、冰雪融化 |
| C、汽油挥发 | D、山体滑坡 |
 盐酸.为区别这三种溶液,在老师指导下,兴趣小组的同学把这三种溶液按A、B、C进行编号,然后分别各取适量作为样品加入到三支试管中,进行了如图所示的探究活动:
盐酸.为区别这三种溶液,在老师指导下,兴趣小组的同学把这三种溶液按A、B、C进行编号,然后分别各取适量作为样品加入到三支试管中,进行了如图所示的探究活动: