题目内容
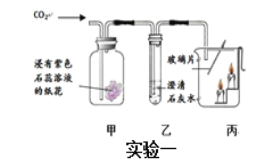
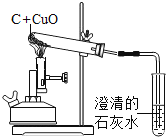
【题目】碳还原氧化铜用如图所示装置实验,现象很明显,写出该反应的化学方程式:________。
现对该实验再认识。
【提出问题】实验得到的红色固体全是Cu吗?
【查阅资料】①氧化亚铜(Cu2O)是红色的;②氧化亚铜不溶于水,与稀硫酸反应生成蓝色溶液。反应的化学方程式为:Cu2O+H2SO4= Cu+CuSO4+H2O
【猜 想】a. 红色固体只有Cu;
b. 红色固体只有Cu2O(Cu2O中铜与氧两种元素的质量比为_________;
c. 红色固体是Cu与Cu2O的混合物。
【实 验】①取适量红色固体加入试管中;
②向其中滴加足量稀硫酸;
③振荡,使其充分反应;
④静置;
⑤观察到溶液显蓝色,_______________________________。
【实验结论1】通过上述实验判断,与之相符的猜想为_________(填猜想序号)。
【继续实验】称取14.4g原红色固体,倒入烧杯中,加入足量稀硫酸,充分反应后,过滤、洗涤、干燥,得固体13.6g。
【实验结论2】原红色固体中氧化亚铜质量为________g。
【答案】 CuO+2C![]() Cu+CO2↑ 8:1 试管底部有红色固体 bc 1.44
Cu+CO2↑ 8:1 试管底部有红色固体 bc 1.44
【解析】本题考查了碳与氧化铜在高温条件下反应产物成分的探究,解题时根据题中提供的信息和实验现象定性分析出产物的成分,再根据提供的数据得到产物的成分。
碳和氧化铜在高温的条件下生成铜和二氧化碳,化学方程式为:CuO+2C![]() Cu+CO2↑;
Cu+CO2↑;
【猜想】元素质量比等于相对原子质量和原子个数乘积的比值,所以Cu2O中铜与氧两种元素的质量比为:(64×2):16=8:1;
【实验】氧化亚铜和稀硫酸反应生成硫酸铜、铜和水,所以观察到溶液显蓝色,试管底部有红色固体;
【实验结论1】通过上述实验判断,与之相符的猜想为bc;
【实验结论2】设原红色固体中氧化亚铜质量为x
Cu2O+H2SO4=Cu+CuSO4+H2O 固体减少质量
144 64 144﹣64=80
x 14.4g﹣13.6g=0.8g
![]() =
=![]()
x=1.44g