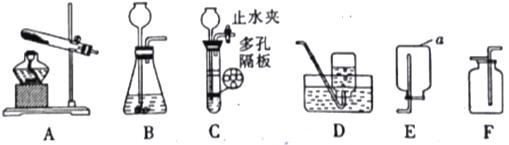
��Ŀ����
����Ŀ��Ϊ�˲�ù�ҵ������̼���Ƶ���������(��������NaCl)��С��ͬѧ��Ƶ�ʵ��װ����ͼ�ף�ȷ��ȡһ�����Ĵ�����Ʒ���ӷ�Һ©���е���ϡ���ᡣ��֪��ʯ�Ҽ�������ˮҲ�����ն�����̼��
(1)ͼ��������a�ڷ����Ļ�ѧ����ʽΪ______________________��
(2)С�����С����ʵ��װ�ûᵼ�½ϴ�����������ͼ�ҵ�װ�ã�����д��ͼ��װ�õ�����(д�����㼴��)��_________________��______________��
(3)С����ͼ��װ�ý���ʵ�飬����Ϊ����ȷ��ȡʢ�м�ʯ�ҵĸ���ܵ�����Ϊ158.0 g����ȷ��ȡ11.0 g������Ʒ��ȫ������A�У�����װȫ����Ӧװ�ò���������ԣ��ر�d����e��μ���ϡ���������ٲ�������Ϊֹ���۴�d�������������10 min�����ٳƸ���ܵ�������Ϊ162.4 g���ò�Ʒ��̼���Ƶ���������Ϊ_______________(�����ȷ��0.1%)��
���𰸡� Na2CO3+H2SO4![]() Na2SO4+H2O+CO2�� �ܹ���ֹˮ������ʵ��ĸ��� ��ʹ��Ӧ���ɵĶ�����̼ȫ������ʯ������ 96.4%
Na2SO4+H2O+CO2�� �ܹ���ֹˮ������ʵ��ĸ��� ��ʹ��Ӧ���ɵĶ�����̼ȫ������ʯ������ 96.4%
����������1��̼���ƺ�ϡ���ᷴӦ���������ơ�ˮ�Ͷ�����̼����2��ʵ��װ�ò�ͬ����ȱ�㲻ͬ��
��3��������ڷ�Ӧǰ��������Ϊ��Ӧ���ɶ�����̼�����������ݶ�����̼�����ͷ�Ӧ�Ļ�ѧ����ʽ���Լ���̼������������һ�����Լ���ò�Ʒ��̼���Ƶ�������������1��ͼ���У�̼���ƺ�ϡ���ᷴӦ���������ơ�ˮ�Ͷ�����̼�������Ļ�ѧ����ʽΪNa2CO3+H2SO4�TNa2SO4+H2O+CO2������2��ͼ��װ�õ��ŵ��ǣ�������̼�е�ˮ�����ܱ�Cװ���е�Ũ�������գ��ܹ���ֹˮ������ʵ��ĸ��ţ�ʵ��������d�������������10min����ʹ��Ӧ���ɵĶ�����̼ȫ������ʯ��������
��3����̼��������Ϊx��
��Ӧ���ɶ�����̼����Ϊ162.4g-158.0g=4.4g
Na2CO3+H2SO4�TNa2SO4+H2O+CO2����
10644
x 4.4g![]()
x=10.6g��
�ò�Ʒ��̼���Ƶ���������Ϊ![]() ��100��=96.4��
��100��=96.4��
�𣺸ò�Ʒ��̼���Ƶ���������Ϊ96.4����

����Ŀ��ij��ѧ��ȤС����Ҫ̽��һ��ʳƷ�������ijɷ֣�������װ����������������Ϊ��ɫ���壬���л���������ɫ��ĩ��
��������⡿�������ijɷ���ʲô��
����������衿�����������ϣ�С��ͬѧ������룺
��ͬѧ������������
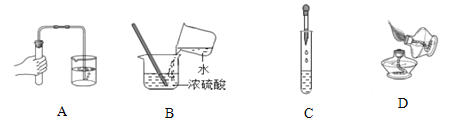
��ͬѧ��������̿�ۣ���Ϊ����̿����__________�ԣ����Խ������е�������������������Χ��
�����ʵ�顿С��ͬѧ������λͬѧ�IJ��������ʵ�鷽����������±���
ʵ�鲽�� | ʵ������ | ʵ����� |
���������м���������_____ | ���岿���ܽ⣬�����ݲ��� | �ס���ͬѧ�IJ�������� |
���ˣ�������������ͭ��ϼ��� | ______________ |
����˼�����ۡ�
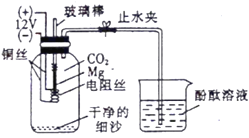
��1������������ͭ�ķ�Ӧ���ڸ��������½��У���ʵ��װ�ýǶȿ��ǣ�����ͨ��___�ķ������ṩ���¡�
��2����ͬѧ�����������һ�ּ�����������֤��ͬѧ�IJ��룬��д��ʹ�ô˷�����ʵ
�����������___________________________��
��3����ʦ����ͬѧ�ǣ�������������ԭ������������������ˮ��Ӧ�����������������հ�
װ�����������Ӷ��ӳ�ʳƷ�ı����ڡ��÷�Ӧ�Ļ�ѧ����ʽ��____________________��
��4��С��ͬѧ�ֶ��������еİ�ɫ��ĩ�������棬���������ϣ���ɫ��ĩ�����ǹ���������������һ��������������ˮ����������������ˮ�֣�Ϊ������Ӧ�ṩˮ�֣����������ϣ�ʹ�������ڽӴ����ۡ���ͼ�ǹ���������������ʱ�䣨h���Ĺ�ϵͼ����֪��
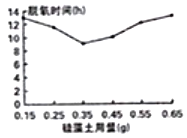
�ٹ����������������__________g��
�ڹ��������ڻ���������ʱ�������ٶȻ������
��ֱ�������ܵ�ԭ��____________________��________________________��
���������������ٶȻ��п�������Щ����Ӱ�죿
��д��һ����˵�����ɣ�_______________________________��
����Ŀ���γǵij��н����ν���������죬�ڳ��н��衢�����������в������Ź㷺��Ӧ�á�
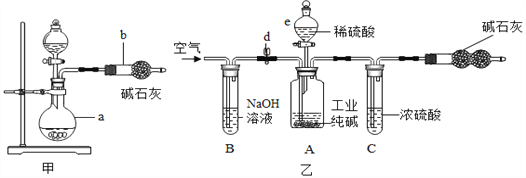
(1)����������Ʒ����Ҫ���ý����������õ����Ե���________(�����)��һ��ͭ����������о���ϩ��Ե�㣬����ϩ����________���ϡ�

(2)����Ʒ�ڿ����лᷢ����ʴ����ԭ������������е�___________��ͬ���õĽ����Ϊ��ֹ������Ʒ����ʴ�������е������Ͳ˵�ͨ�������ķ�����_____________(Ҫ��һ�ַ�������)��
(3)��ѧС��Ϊ����֤����ͭ��þ�����Ľ������˳�����������ʵ�鷽����

����ʵ��һ�жϳ�þ�Ľ�����Ա���ǿ�����ݵ�������___________������ʵ���������Ӧ�ó��Ľ�����__________��
(4)����ͬѧ����FeSO4��CuSO4�������ʵ���Һ�У�����һ������þ�ۣ���ַ�Ӧ����ˣ���Һ��dz��ɫ��������Һ�з���һö�ྻ���������㹻ʱ���ȡ�������������ޱ仯�����ݴ����������������жϣ�����Ϊ��ȷ����_____________(�����)��
A. ��ֽ��һ����Fe��������Mg��Cu
B. ��ֽ��һ����Cu��������Fe��һ��û��Mg
C. ��Һ��һ����FeSO4��������MgSO4 ��CuSO4
D. ��Һ��һ����MgSO4��FeSO4��һ��û��CuSO4
(5)Ϊ����ij������ͭ��ͭ��ɵĻ����������ͭ��������������ȡ3�ݸû�����20g���ֱ������뵽50g��100g��150gijϡ�����У��������ʵ�����������
��I�� | �ڢ��� | �ڢ��� | |
ϡ���������/g | 50 | 100 | 150 |
�ܽ���������/g | 10.0 | 16.0 | 16.0 |
����ʵ�鼰�й����ݽ��з�������㣺
�ٵ�I��ʵ���з�Ӧ��___________(��������ͭ������ϡ��������������ͭ��ϡ������)��Ӧ�ꡣ
��20g��Ʒ�к�����ͭ�����������ֱ�Ϊ____________��
�ۼ������õ�ϡ�������ʵ���������Ϊ____________(д���������)
�ܽ��ڢ���������ˣ�����Һ�еμ�10%��NaOH��Һ�������ڸû����Һ�м���10%NaOH��Һ�����������ɳ��������仯��ϵ������ͼ��
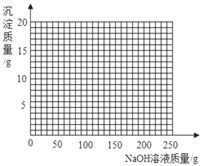 ___________________
___________________