��Ŀ����
����Ŀ���ҹ����������ۣ�������Դʮ�ַḻ��

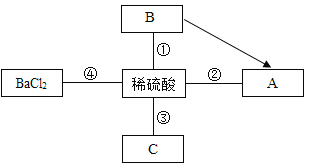
��1����ͼ����ʾ���Ӻ�ˮ�л�õ�ˮ�ķ����� ������Ϊ�ü������ŵ��� ������ͼ����ʾ���Ǻ�����ģ�⺣ˮɹ�ι��̵�ʾ��ͼ������ձ��ձ���Һ��������������һ����ͬ���� ������ţ���ͬ����
��2���Ӻ�ˮ����ȡ����þ���ɰ���ͼ���̽��У�

��д�����������Ӧ�Ļ�ѧ����ʽ ��
�ڸ�������ͼ������˵����ȷ���� ��
A�������ͨ��һ����Ӧ����ʵ��
B���������Ŀ���ǴӺ�ˮ���ᴿ����þ
C������������кͷ�Ӧ
D��������л�ѧ��ת��Ϊ����
�۸������в�ȡ��һ�ֽ��ͳɱ��Ҽ�����Ⱦ�Ĵ�ʩ�� ��
��3���ҹ�������ѧ�Һ�°����ġ������Ƽ����Ҫ��������ʾ��ͼ���£�

Ϊ�˳�ȥ����ˮ�п��������ʣ��ɼ����������ʣ����ù��˵Ȳ������г��ӣ�����������������ʵ��Ⱥ�˳��Ϊ ��
a���Թ�����Na2CO3��Һ b������������ c���Թ�����Ba��OH��2��Һ������һ��������Һ����Һ��pH 7����������������T�������Ӷ���������������A������һ��Ӧ�Ļ�ѧ����ʽΪ ��
�ۼ��ȹ���A��Ӧ�Ļ�ѧ����ʽΪ ��
���𰸡���1��������Լ��Դ�����ٳɱ���������2����Ca��OH��2+MgCl2=Mg��OH��2��+CaCl2��BC���۽��ж�������ת��Ϊ���ᣬ�Ƚ��ͳɱ��ּ�����Ⱦ����3���� cba����NH3+NaCl+H2O+CO2=NaHCO3+NH4Cl����2NaHCO3![]() Na2CO3+H2O+CO2����
Na2CO3+H2O+CO2����
����������1����ͼ����ʾ���Ӻ�ˮ�л�õ�ˮ�ķ���������ʹ�øü������ŵ��ǽ�Լ��Դ�����ٳɱ���������ģ�⺣ˮɹ�ι��̵�ʾ��ͼ�����Ͷ����DZ�����Һ��������ձ��ձ���Һ��������������һ����ͬ���Ƕ������������Լ��Դ�����ٳɱ�������
��2�����������������Ȼ�þ��Ӧ����������þ�������Ȼ��ƣ����Ca��OH��2+MgCl2=Mg��OH��2��+CaCl2��
��A�������ͨ��̼��Ƹ��·ֽ����������ƺ�ˮ������������ˮ��Ӧ�����������ƣ�����ͨ��һ����Ӧʵ�֣�����
B���������Ŀ���ǴӺ�ˮ���ᴿ����þ����ȷ��
C���������������þ�����ᷴӦ�����������кͷ�Ӧ����ȷ��
D����������ǵ���ת��Ϊ��ѧ�ܣ�����
���BC��
�۸������в�ȡ��һ�ֽ��ͳɱ��Ҽ�����Ⱦ�Ĵ�ʩ�ǽ��ж�������ת��Ϊ���ᣬ�Ƚ��ͳɱ��ּ�����Ⱦ��������ж�������ת��Ϊ���ᣬ�Ƚ��ͳɱ��ּ�����Ⱦ��
��3Ϊ�˳�ȥ����ˮ�п��������ʣ��ɼ����Թ�����Ba��OH��2��Һ���Թ�����Na2CO3��Һ�����������ᣬ���ù��˵Ȳ������г��ӣ��ʼ��������������ʵ��Ⱥ�˳��Ϊ cab�����cba��
������һ��������Һ����Һ�ʼ��ԣ���Һ��pH����7���Ӷ���������������A������һ��Ӧ�Ļ�ѧ����ʽΪNH3+NaCl+H2O+CO2=NaHCO3+NH4Cl�����NH3+NaCl+H2O+CO2=NaHCO3+NH4Cl��
�ۼ��ȹ���̼�����Ʒֽ�����̼���ơ�ˮ�Ͷ�����̼�����2NaHCO3![]() Na2CO3+H2O+CO2����
Na2CO3+H2O+CO2����

 �Ƹ�360�ȶ����ܾ�ϵ�д�
�Ƹ�360�ȶ����ܾ�ϵ�д� ���⿼����Ԫ���Ծ�ϵ�д�
���⿼����Ԫ���Ծ�ϵ�д� ��У���˳�̾�ϵ�д�
��У���˳�̾�ϵ�д� ��У���һ��ͨϵ�д�
��У���һ��ͨϵ�д�����Ŀ��������ǰ������ࡢ�ȼ������ʷֱ���ࡣ���ݲ�ͬ�ķ����������Ҳ������ͬ������ÿ������һ�����ʾ����������ɻ����ʣ��������������ʵ���ɻ��������ơ�����������ѧ֪ʶ�������ֳ�����˵�����ɡ�
��ѧʽ | �����ֵ����ʣ����ƣ� | ���� |
Na2CO3��CaCO3��NaCl | NaCl | |
C��CO2��H2CO3 | ���� |
����Ŀ���±��и������ʲ��ܰ���ͼ�й�ϵ����ͷ��ʾ��Ӧһ����ɣ�ת������
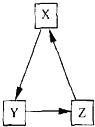
����ѡ�� | A | B | C | D |
X | Na2SO4 | BaCl2 | Cu | CaO |
Y | NaCl | Ba��NO3��2 | CuO | CaCl2 |
Z | NaNO3 | BaCO3 | Cu��OH��2 | CaCO3 |
A��A B��B C��C D��D