题目内容
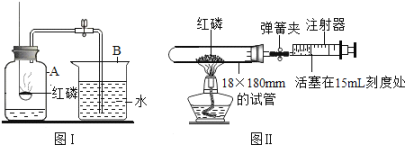
【题目】资料显示,将新制的浓度为5%的H2O2溶液加热到80℃时,才有较多氧气产生。小红为了探究温度对H2O2分解反应速率的影响,借助下图所示实验装置(加持装置略去),进行了两次实验,两次实验的部分设计如下表所示:
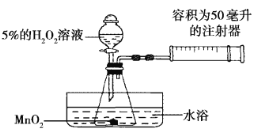
实验1 | 实验2 | |
MnO2 | 0.5 | 0.5 |
5%的H2O2溶液的体积/毫升 | 40 | 待填 |
水浴温度/ | 20 | 80 |
(1)①写出实验中发生化学反应的符号表达式___________,基本反应类型是___________。
②实验2中应加入5%H2O2溶液__________毫升。
③在两次实验中,可通过_________来比较H2O2溶液分解反应速率的大小。
④实验2中水浴温度控制在80℃时,测定的反应速率会比真实值偏大,其原因除锥形瓶内气体受热膨胀外,还有______________。
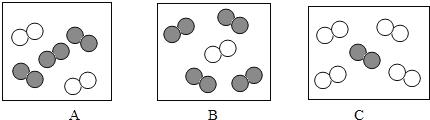
(2)实验探究:如图所示,向三支试管中分别滴加浓度相同的三种溶液,观察可见:实验①中无明显现象,实验②中产生气泡,实验③中产生气泡更快,据悉你能得出的结论是________________。

【答案】H2O2![]() H2O+O2 分解反应 40 相同的时间内注射器内气体的体积 温度较高时水蒸发成水蒸气 硫酸铜和氯化铁对过氧化氢分解有催化作用,且氯化铁的催化效果更好
H2O+O2 分解反应 40 相同的时间内注射器内气体的体积 温度较高时水蒸发成水蒸气 硫酸铜和氯化铁对过氧化氢分解有催化作用,且氯化铁的催化效果更好
【解析】
⑴①过氧化氢在二氧化锰的作用下分解生成水和氧气,符号表达式H2O2![]() H2O+O2,基本反应类型是由一种物质生成两种物质的分解反应;
H2O+O2,基本反应类型是由一种物质生成两种物质的分解反应;
②)利用对比试验探究温度对H2O2分解反应速率的影响时,变量应是温度,其余的量应相同,所以,实验2中应加入5%H2O2溶液40毫升;
③在两次实验中,可通过相同的时间内注射器内气体的体积来比较H2O2分解反应速率的大小;
④实验2中水浴温度控制在80℃时,测定的反应速率会比真实值偏大,其原因除锥形瓶内气体受热膨胀外,还有温度较高时水蒸发成水蒸气;
(2)实验探究:向三支试管中分别滴加浓度相同的三种溶液,观察可见:实验①中无明显现象,实验②中产生气泡,实验③中产生气泡更快,据此能得出的结论是硫酸铜和氯化铁对过氧化氢分解有催化作用,且氯化铁的催化效果更好。

 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案