题目内容
(10,深圳44)、某兴趣小组为了测定铜锌合金(不含有其它杂质)中锌的质量分数,取出10g合金样品放入试管中,加入足量稀硫酸充分反应后,溶液中还剩余部分固体,试管中物质总质量减少0.1g,请回答
⑴溶液中剩余固体成分是___________
⑵试管中物质总质量减少0.1g,是因为生成了_______
⑶样品中锌的质量是_______________g
⑷、样品中锌的质量分数是________%
⑴溶液中剩余固体成分是___________
⑵试管中物质总质量减少0.1g,是因为生成了_______
⑶样品中锌的质量是_______________g
⑷、样品中锌的质量分数是________%
(1)铜或Cu(2)氢气或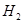 (填氢不给分)
(填氢不给分)
(3)3.25(4)32.5(答案带单位和百分号的也不扣分)
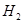 (填氢不给分)
(填氢不给分)(3)3.25(4)32.5(答案带单位和百分号的也不扣分)
本题考查的是根据化学反应方程式的计算,根据金属活动性顺序,锌>氢>铜,合金加入稀硫酸时,锌与硫酸反应生成硫酸锌同时放出氢气,而铜不能与稀硫酸反应,因此充分反应后剩余固体为不能反应的铜,整个反应只有氢气逸出,故试管中物质总质量减少的质量是放出氢气的质量,所以氢气质量为0.1g,可设锌的质量为x,则
Zn+H2SO4=ZnSO4+H2↑
65 2
X 0.1g
65/2 ="x/0.1g"
x=3.25g
样品中锌的质量分数是3.25g/10g×100℅=32.5℅
Zn+H2SO4=ZnSO4+H2↑
65 2
X 0.1g
65/2 ="x/0.1g"
x=3.25g
样品中锌的质量分数是3.25g/10g×100℅=32.5℅

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 2H2↑+O2↑)
2H2↑+O2↑)