题目内容
2012年4月15日央视《每周质量报告》报道的“毒胶囊”中使用的明胶含有重铬酸钾(K2Cr2O7),其中的铬(Cr)是有毒的重金属元素。计算:
(1)重铬酸钾中钾、铬、氧元素的质量比是 。
(2)重铬酸钾中铬元素的质量分数是 。(精确到0.1%)
(3)14.7g重铬酸钾中含铬元素的质量是 g。
(1)重铬酸钾中钾、铬、氧元素的质量比是 。
(2)重铬酸钾中铬元素的质量分数是 。(精确到0.1%)
(3)14.7g重铬酸钾中含铬元素的质量是 g。
(1)39:52:56;(2)35.4%;(3)5.2g
试题分析:(1)根据化合物中各元素质量比=各元素的相对原子质量×原子个数之比,进行解答,则重铬酸钾中钾、铬、氧元素的质量比为:(39×2):(52×2):(16×7)=39:52:56;
(2)根据物质中某元素的质量分数=
 ×100%,进行解答,则重铬酸钾中铬元素的质量分数为:
×100%,进行解答,则重铬酸钾中铬元素的质量分数为: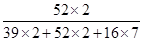 ×100%=35.4%;
×100%=35.4%;(3)根据化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答,则14.7g重铬酸钾中含有铬元素的质量为14.7g×35.4%=5.2g。

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
