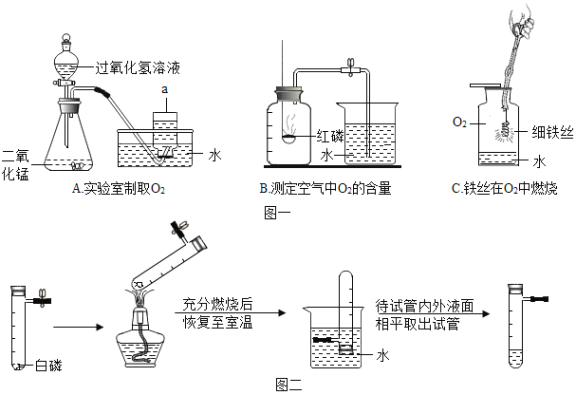
题目内容
【题目】下图 A、B、C、D、E 是五种粒子的结构示意图,请回答下列问题:
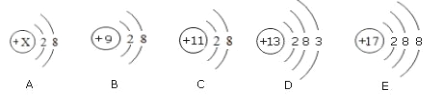
(1)若 A 粒子表示带两个单位的正电荷,该粒子符号为__________;
(2)B、C、D、E 四种粒子中表示阴离子的有__________;(填字.母.序.号.)
(3)E 粒子对应的元素与地壳中含量最多的金属元素组成的物质的化学式为__________。
【答案】Mg2+ BE AlCl3
【解析】
(1)根据该粒子带两个单位正电荷,可判断该粒子的原子核外有12个电子,根据原子序数=核外电子数可知,该元素是镁,因此该粒子是镁离子,其符号为Mg2+;
(2)阴离子中,核内质子数<核外电子数,B、C、D、E 四种粒子中表示阴离子的有BE;
(3)E粒子质子数为17,电子数为18,为氯离子,地壳中含量最多的金属元素为铝元素,其组成的化学式为:AlCl3。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】某同学想定量测定某红色粉末中氧化铁的质量分数,进行如下实验:
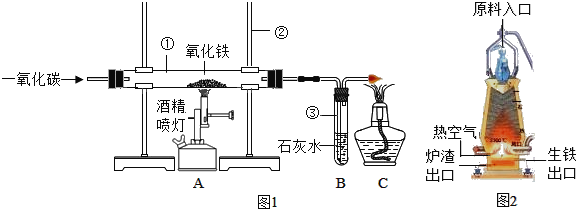
(1)图1是实验室模拟炼铁的装置图,试回答
实验步骤:按上图连接实验装置、 _______、装药品、固定实验装置后,剩下的主要实验步骤有:①通入一氧化碳;②停止通入一氧化碳;③点燃酒精灯;④熄灭酒精灯;⑤点燃酒精喷灯;⑥熄灭酒精喷灯.正确的操作顺序是(填序号)__________.
(2)实验过程中,仪器①中的现象___________,所发生反应的化学方程式是_________仪器③中所发生反应化学方程式是_______。
(3)请写出证明产物中含铁粉的一种化学方法:____________.
(4)实验过程中产生的尾气不能直接排放的原因是____________.请从节能的角度出发,对于尾气处理,你有什么好的建议:____________
(5)定量测定该红色粉末中氧化铁的质量分数
某同学称取该红色粉末5.0g装入硬质玻璃管中,完全反应后,称量相关物质的总质量其数据如下表:
反应前 | 反应后 |
玻璃管和红色粉末总质量 48.3g | 玻璃管和固体物质总质量47.1g |
根据上述表格中的实验数据计算:红色粉末中氧化铁的质量分数为____.(写出计算过程,)
(6)如图2是工业生产中炼铁高炉的结构图.实际生产中炼铁的原料有铁矿石、热空气、石灰石、以及_____________;该物质有两个作用,第一个作用提供能量,另一个作用是__________;生铁出口低于炉渣出口的原因是_________。