题目内容
有一包未知粉末,其中含有碳酸钠、氢氧化钠、碳酸钙、生石灰、氯化钠、硫酸铜六种物质中的四种.兴趣小组为确定其组成设计并进行如下实验.【实验一】甲组同学进行定性探究.
| 实验操作 | 实验现象 | 实验结论及分析 |
| (1)取少量该未知粉末于烧杯中,加入足量的水溶解、过滤. | 粉末部分溶解, 得到白色滤渣和无色滤液. |
原粉末中一定不含 白色滤渣不一定是原粉末中的碳酸钙,其理由是 |
| (2)向滤液中滴加无色酚酞试液. | 溶液变红 | 滤液中存在碱性物质. |
| (3)向(2)中滴加足量稀盐酸. | 原固体粉末中一定含有Na2CO3. |
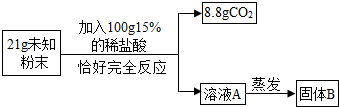
实验测得固体B中含15g氯元素.试综合甲、乙两组同学的实验进行分析.
(1)乙组实验中一定发生的化学反应是:Na2CO3+2HCl=2NaCl+H2O+CO2↑和
(2)该未知粉末的组成可能是
分析:硫酸铜的水溶液为蓝色,氧化钙与水反应生成氢氧化钙,氢氧化钙能与碳酸钠反应生成碳酸钙沉淀,碳酸钠能与盐酸反应生成二氧化碳气体,可以用于检验碳酸钠的存在,100g15%的盐酸含有氯元素的质量为14.6g,而固体B中含有15g氯元素,则混合物中一定含有含氯元素的物质,根据生成二氧化碳的质量,可以推知还能发生的化学反应.
解答:解:试验一:硫酸铜的水溶液为蓝色,得到的是无色滤液,则一定不含硫酸铜,粉末中含有的氧化钙能与水反应生成氢氧化钙,生成的氢氧化钙能与碳酸钠反应生成碳酸钙沉淀,所以得到的沉淀不一定是原粉末中的碳酸钙,原粉末中一定含有碳酸钠,则加入盐酸能反应生成二氧化碳气体,且溶液的碱性消失,所以本题答案为:
实验二:(1)设生成8.8g二氧化碳需要碳酸钠的质量为x,则有
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 8.8g
=
x=21.2g
而粉末的质量只有21g,所以生成8.8g二氧化碳还需要碳酸钙,所以一定会发生碳酸钙与盐酸的反应,所以本题答案为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(2)100g15%的盐酸含有氯元素的质量为:100g×15%×
×100%≈14.6g,而固体B中含有15g氯元素,则混合物中一定含有含氯元素的物质,即一定含有氯化钠,所以本题答案为:Na2CO3、NaCl、CaCO3、NaOH或Na2CO3、NaCl、CaCO3、CaO.
| 实验操作 | 实验现象 | 实验结论及分析 |
| 一定不含硫酸铜, CaO+H2O=Ca(OH)2 Na2CO3+Ca(OH)2=CaCO3↓+2NaOH | ||
| 溶液由红色变为无色,有气泡生成 |
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 8.8g
| 106 |
| x |
| 44 |
| 8.8g |
x=21.2g
而粉末的质量只有21g,所以生成8.8g二氧化碳还需要碳酸钙,所以一定会发生碳酸钙与盐酸的反应,所以本题答案为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(2)100g15%的盐酸含有氯元素的质量为:100g×15%×
| 35.5 |
| 36.5 |
点评:本题为文字叙述型物质推断题,完成此题关键是找准解题突破口,直接得出有关有关物质的化学式,然后根据实验的现象及题干提供的实验数据逐步推导得出其他物质的化学式.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
有一包未知粉末,其中含有碳酸钠、氢氧化钠、碳酸钙、生石灰、氯化钠、硫酸铜六种物质中的四种。兴趣小组为确定其组成设计并进行如下实验。
【实验一】甲组同学进行定性探究。
|
实验操作 |
实验现象 |
实验结论及分析 |
|
(1)取少量该未知粉末于烧杯中,加入足量的水溶解、过滤。 |
粉末部分溶解, 得到白色滤渣和无色滤液。 |
原粉末中一定不含_____; 白色滤渣不一定是原粉末中的碳酸钙,其理由是_____(用化学方程式表示)。 |
|
(2)向滤液中滴加无色酚酞试液。 |
溶液变红 |
滤液中存在碱性物质。 |
|
(3)向(2)中滴加足量稀盐酸。 |
|
原固体粉末中一定含有Na2CO3。 |
【实验二】乙组同学进行定量探究。

实验测得固体B中含15 g氯元素。试综合甲、乙两组同学的实验进行分析。
(1)乙组实验中一定发生的化学反应是:Na2CO3+ 2HCl=2NaCl + H2O+ CO2↑和 。
(2)该未知粉末的组成可能是 。
有一包未知粉末,其中含有碳酸钠、氢氧化钠、碳酸钙、生石灰、氯化钠、硫酸铜六种物质中的四种.兴趣小组为确定其组成设计并进行如下实验.
【实验一】甲组同学进行定性探究.
| 实验操作 | 实验现象 | 实验结论及分析 |
| (1)取少量该未知粉末于烧杯中,加入足量的水溶解、过滤. | 粉末部分溶解, 得到白色滤渣和无色滤液. | 原粉末中一定不含________; 白色滤渣不一定是原粉末中的碳酸钙,其理由是________(用化学方程式表示). |
| (2)向滤液中滴加无色酚酞试液. | 溶液变红 | 滤液中存在碱性物质. |
| (3)向(2)中滴加足量稀盐酸. | ________ | 原固体粉末中一定含有Na2CO3. |

实验测得固体B中含15g氯元素.试综合甲、乙两组同学的实验进行分析.
(1)乙组实验中一定发生的化学反应是:Na2CO3+2HCl=2NaCl+H2O+CO2↑和________.
(2)该未知粉末的组成可能是________.
有一包未知粉末,其中含有碳酸钠、氢氧化钠、碳酸钙、生石灰、氯化钠、硫酸铜六种物质中的四种.兴趣小组为确定其组成设计并进行如下实验.
【实验一】甲组同学进行定性探究.
【实验二】乙组同学进行定量探究.

实验测得固体B中含15g氯元素.试综合甲、乙两组同学的实验进行分析.
(1)乙组实验中一定发生的化学反应是:Na2CO3+2HCl=2NaCl+H2O+CO2↑和______.
(2)该未知粉末的组成可能是______.
【实验一】甲组同学进行定性探究.
| 实验操作 | 实验现象 | 实验结论及分析 |
| (1)取少量该未知粉末于烧杯中,加入足量的水溶解、过滤. | 粉末部分溶解, 得到白色滤渣和无色滤液. | 原粉末中一定不含______; 白色滤渣不一定是原粉末中的碳酸钙,其理由是______(用化学方程式表示). |
| (2)向滤液中滴加无色酚酞试液. | 溶液变红 | 滤液中存在碱性物质. |
| (3)向(2)中滴加足量稀盐酸. | ______ | 原固体粉末中一定含有Na2CO3. |

实验测得固体B中含15g氯元素.试综合甲、乙两组同学的实验进行分析.
(1)乙组实验中一定发生的化学反应是:Na2CO3+2HCl=2NaCl+H2O+CO2↑和______.
(2)该未知粉末的组成可能是______.
(2011?西城区二模)有一包未知粉末,其中含有碳酸钠、氢氧化钠、碳酸钙、生石灰、氯化钠、硫酸铜六种物质中的四种.兴趣小组为确定其组成设计并进行如下实验.
【实验一】甲组同学进行定性探究.
【实验二】乙组同学进行定量探究.

实验测得固体B中含15g氯元素.试综合甲、乙两组同学的实验进行分析.
(1)乙组实验中一定发生的化学反应是:Na2CO3+2HCl=2NaCl+H2O+CO2↑和______.
(2)该未知粉末的组成可能是______.
【实验一】甲组同学进行定性探究.
| 实验操作 | 实验现象 | 实验结论及分析 |
| (1)取少量该未知粉末于烧杯中,加入足量的水溶解、过滤. | 粉末部分溶解, 得到白色滤渣和无色滤液. | 原粉末中一定不含______; 白色滤渣不一定是原粉末中的碳酸钙,其理由是______(用化学方程式表示). |
| (2)向滤液中滴加无色酚酞试液. | 溶液变红 | 滤液中存在碱性物质. |
| (3)向(2)中滴加足量稀盐酸. | ______ | 原固体粉末中一定含有Na2CO3. |

实验测得固体B中含15g氯元素.试综合甲、乙两组同学的实验进行分析.
(1)乙组实验中一定发生的化学反应是:Na2CO3+2HCl=2NaCl+H2O+CO2↑和______.
(2)该未知粉末的组成可能是______.