题目内容
(2005?包头)有一不纯的硫酸铵样品(杂质中不含氮元素),经分析知道其中含氮的质量分数为18.9%,则样品中含(NH4)2SO4的质量分数为
89.15%
89.15%
.分析:先根据公式:化合物中某元素的质量分数=
× 100%求出硫酸铵中氮元素的质量分数,再根据:混合物中某物质的质量分数=
×100%=
×100%,求出样品中硫酸铵的质量分数.
| 该元素的相对原子质量×该元素的原子个数 |
| 化合物的相对原子质量 |
| 该纯净物的质量 |
| 混合物的质量 |
| 混合物中某元素的质量分数 |
| 纯净物中某元素的质量分数 |
解答:解:(NH4)2SO4中氮元素的质量分数=
×100%=
×100%=21.2%
所以样品中(NH4)2SO4的质量分数=
×100%=89.15%
故答案是:89.15%
| N的相对原子质量×N的原子个数 |
| (NH4)2SO4的相对分子质量 |
| 28 |
| 132 |
所以样品中(NH4)2SO4的质量分数=
| 18.9% |
| 21.2% |
故答案是:89.15%
点评:此题考查有关化学式的计算.混合物中该物质的质量分数=
×100%,理解并学会运用这个公式,即可轻松解题.
| 混合物中某元素的质量分数 |
| 纯净物中某元素的质量分数 |

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
 (2005?包头)在医院给病人输氧气时,也利用了类似的装置,并在装置中盛放约半瓶蒸馏水,以下说法中不正确的是( )
(2005?包头)在医院给病人输氧气时,也利用了类似的装置,并在装置中盛放约半瓶蒸馏水,以下说法中不正确的是( ) (2005?包头)甲、乙两种固体物质的溶解度曲线如图所示.现将两支分别装有甲、乙两种物质饱和溶液(底部均有未溶解的固体)的试管浸入盛有水的烧杯里,然后向烧杯中加入一定量的浓硫酸.甲试管内产生的现象是
(2005?包头)甲、乙两种固体物质的溶解度曲线如图所示.现将两支分别装有甲、乙两种物质饱和溶液(底部均有未溶解的固体)的试管浸入盛有水的烧杯里,然后向烧杯中加入一定量的浓硫酸.甲试管内产生的现象是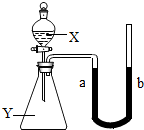 (2005?包头)如图所示,锥形瓶内盛有物质Y(可能为气体、溶液或固体),分液漏斗内盛有液体X,U形管内盛有红墨水(便于观察).开始时a、b处于同一水平线,当把X滴入锥形瓶内时.回答下列问题:
(2005?包头)如图所示,锥形瓶内盛有物质Y(可能为气体、溶液或固体),分液漏斗内盛有液体X,U形管内盛有红墨水(便于观察).开始时a、b处于同一水平线,当把X滴入锥形瓶内时.回答下列问题: 3Cu+A12O3.反应结束后,为了检验氧化铜是否完全反应,取少量反应后的固体,加入足量稀硫酸,充分反应后,将铁片插入溶液中.下列叙述的现象中,能够说明氧化铜没有完全反应的是( )
3Cu+A12O3.反应结束后,为了检验氧化铜是否完全反应,取少量反应后的固体,加入足量稀硫酸,充分反应后,将铁片插入溶液中.下列叙述的现象中,能够说明氧化铜没有完全反应的是( )