题目内容
草木灰是农村常用的一种肥料(其有效成分为碳酸钾),为测定草木灰中碳酸钾的含量,现称取草木灰样品8.0g,向其中加入39.8g的水(杂质不溶于水),碳酸钾全部溶解,过滤,除去杂质,向滤液中加入30g稀盐酸,恰好完全反应,放出2.2g气体:
(草木灰与稀盐酸反应的化学方程式为:K2CO3+2HCl=2KCl+H2O+CO2↑).求:
(1)该草木灰中碳酸钾的质量;
(2)反应后溶液中溶质的质量分数.
解:设草木灰中碳酸钾的质量为x,反应后溶液中溶质KCl的质量为y,
K2CO3+2HCl=2KCl+H2O+CO2↑
138 149 44
x y 2.2g
 x=7.9g
x=7.9g
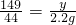 y=7.45g
y=7.45g
反应后溶液中溶质的质量分数为 100%≈9.9%.
100%≈9.9%.
答:(1)该草木灰中碳酸钾的质量为7.9g;(2)反应后溶液中溶质的质量分数为9.9%.
分析:碳酸钾与稀盐酸反应生成氯化钾、水和二氧化碳,由产生二氧化碳气体的质量2.2g,根据反应的化学方程式计算出草木灰中碳酸钾的质量、反应后溶液中溶质氯化钾的质量、反应后溶液中溶质的质量分数.
点评:本题难度不大,掌握根据化学方程式与溶质质量分数的计算即可正确解答本题,根据质量守恒定律计算出生成溶液的质量是正确解答反应后溶液中溶质的质量分数的关键.
K2CO3+2HCl=2KCl+H2O+CO2↑
138 149 44
x y 2.2g
 x=7.9g
x=7.9g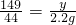 y=7.45g
y=7.45g反应后溶液中溶质的质量分数为
 100%≈9.9%.
100%≈9.9%.答:(1)该草木灰中碳酸钾的质量为7.9g;(2)反应后溶液中溶质的质量分数为9.9%.
分析:碳酸钾与稀盐酸反应生成氯化钾、水和二氧化碳,由产生二氧化碳气体的质量2.2g,根据反应的化学方程式计算出草木灰中碳酸钾的质量、反应后溶液中溶质氯化钾的质量、反应后溶液中溶质的质量分数.
点评:本题难度不大,掌握根据化学方程式与溶质质量分数的计算即可正确解答本题,根据质量守恒定律计算出生成溶液的质量是正确解答反应后溶液中溶质的质量分数的关键.

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案
相关题目