题目内容
(2009?东城区一模)甲、乙、丙三位同学用下列试剂分别进行实验,均恰好完全反应,有关实验数据如下表:| 所用试剂及质量 | 反应后所得溶液质量 | |
| 甲 | CaO(固)a1g,10%盐酸b1g | c1g |
| 乙 | Ca(OH)2(固)a2g,10%盐酸b2g | c2g |
| 丙 | CaCO3(固)a3g,10%盐酸b3g | c3g |
现将甲、乙、丙三位同学反应后所得的溶液全部倒入一个容器内,称得此溶液质量为158.1g.试求:
(1)参加反应的碳酸钙固体的质量.(写出计算过程)
(2)反应后所得溶液中溶质的质量分数是______%.
(3)反应过程中共生成水的质量是______g.
【答案】分析:(1)这三个反应中只有丙会生成气体二氧化碳,因而反应前后烧杯中的物质减少的质量为二氧化碳的质量,利用碳酸钙与盐酸反应的化学方程式,根据二氧化碳的质量可求出碳酸钙的质量.
(2)将三个反应的化学方程式写出来,会发现这三个反应中参加反应的盐酸与生成的氯化钙的质量比值一样,可根据盐酸的质量求出氯化钙的质量,再根据 ×100%即可求出反应后所得溶液中溶质的质量分数.
×100%即可求出反应后所得溶液中溶质的质量分数.
(3)反应后所得溶液中包括氯化钙、原稀盐酸中的水和反应生成的水,用反应后所得溶液的质量-原稀盐酸中的水的质量-氯化钙的质量即可求出反应生成水的质量.
解答:解:(1)反应后生成CO2的质量为:16.5g+146g-158.1g=4.4g
设参加反应的碳酸钙固体质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 4.4g
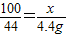 ,x=10g
,x=10g
答:参加反应的碳酸钙固体的质量为10g.
(2)设生成氯化钙的质量为y
CaO+2HCl=CaCl2+H2O
Ca(OH)2+2HCl=CaCl2+2H2O
CaCO3+2HCl=CaCl2+H2O+CO2↑
73 111
146g×10% y
=14.6g
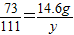 ,y=22.2g
,y=22.2g
反应后所得溶液中溶质的质量分数是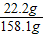 ×100%=14.0%.
×100%=14.0%.
故答案为:14.0
(3)158.1g-22.2g-(146g-14.6g)=4.5g.
故答案为:4.5
点评:本道题目比较难,尤其是第二小题,它不是根据某一个化学方程式进行计算,而是总结出某几个化学反应在质量方面的共同点,然后以一个化学方程式为代表进行计算.
(2)将三个反应的化学方程式写出来,会发现这三个反应中参加反应的盐酸与生成的氯化钙的质量比值一样,可根据盐酸的质量求出氯化钙的质量,再根据
 ×100%即可求出反应后所得溶液中溶质的质量分数.
×100%即可求出反应后所得溶液中溶质的质量分数.(3)反应后所得溶液中包括氯化钙、原稀盐酸中的水和反应生成的水,用反应后所得溶液的质量-原稀盐酸中的水的质量-氯化钙的质量即可求出反应生成水的质量.
解答:解:(1)反应后生成CO2的质量为:16.5g+146g-158.1g=4.4g
设参加反应的碳酸钙固体质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 4.4g
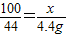 ,x=10g
,x=10g答:参加反应的碳酸钙固体的质量为10g.
(2)设生成氯化钙的质量为y
CaO+2HCl=CaCl2+H2O
Ca(OH)2+2HCl=CaCl2+2H2O
CaCO3+2HCl=CaCl2+H2O+CO2↑
73 111
146g×10% y
=14.6g
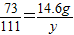 ,y=22.2g
,y=22.2g 反应后所得溶液中溶质的质量分数是
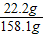 ×100%=14.0%.
×100%=14.0%.故答案为:14.0
(3)158.1g-22.2g-(146g-14.6g)=4.5g.
故答案为:4.5
点评:本道题目比较难,尤其是第二小题,它不是根据某一个化学方程式进行计算,而是总结出某几个化学反应在质量方面的共同点,然后以一个化学方程式为代表进行计算.

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案
相关题目